将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O2 2CO+O2
2H2+O2 2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_________和_________,或_________和_________ (填它们的化学式)。
(2)若平衡时O2和CO2的物质的量分别为n平(O2)="a" mol,n平(CO2)="b" mol。试求n平(H2O)="________" (用含a、b的代数式表示)。
已知四种短周期元素形成的离子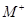 、
、 、
、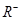 、
、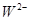 具有相同的电子层结构。(用推断出的元素符号表示)
具有相同的电子层结构。(用推断出的元素符号表示)
①M、N、R、W的原子序数由大到小的顺序是。
②M、N、R、W的原子半径由大到小的顺序是。
③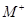 、
、 、
、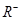 、
、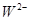 的离子半径由大到小的顺序是 。
的离子半径由大到小的顺序是 。
0.5mol 的Y元素的离子得到6.02×1023个电子被还原成中性原子,0.4gY的氧化物恰好与100ml 0.2mol .L-1 的盐酸完全反应,Y原子核内质子数和中子数相等。写出:
(1)Y的名称为,它在周期表的位置为
(2)Y的氧化物与盐酸反应的离子方程式为。
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则B为(填元素符号)____________,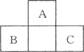
画出A的离子结构示意图: ______________,
C的最高价氧化物的分子式:__________________
用电子式表示A的氢化物分子的形成过程:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: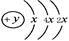 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为,其气态氢化物的化学式为。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为。
(3)B和C最高价氧化物的水化物化学式分别为和。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)D元素位于周期表中周期族。
(2)写出C2B的水化物与Al(OH)3反应的离子反应方程式 。
(3)画出B的原子结构简图 ___________________。
(4)电子式表示化合物 C2D 的形成过程: 。