天然碱是一种重要的矿物质,盛产于我国的青海湖地区。某天然碱样品的成分可以看成是碳酸钠、碳酸氢钠和水按物质的量之比1:1:2形成的结晶水合物。请回答下列问题:
(1)这种天然碱中碳酸钠、碳酸氢钠和水三者的质量比为 。
(2)45.2 g此天然碱与100 mL密度为1.1 g/cm3的中等浓度盐酸恰好完全反应,产生a mol CO2,则a= ,盐酸中溶质的质量分数ω(HCl)= %。
(3)用一个化学方程式表示该天然碱与盐酸的反应:
。
根据下面的反应路线及所给信息填空:
(1)A的结构简式是,名称是
(2)①的反应类型②的反应类型
(3)反应④的化学方程式
某烯烃与H2发生加成反应后得到的产物是CH3—CH(CH3)2.
(1)该产物的名称是;
(2)原来烯烃的结构简式为:;
(3)写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式:
按系统命名法命名,或写出结构简式.
(1)有机物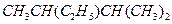 的名称是。
的名称是。
(2)2,3-二甲基-4-乙基已烷
(3)支链只有一个乙基且式量最小的烷烃
(1)玻璃棒在中学化学实验中一般有如下三种用途:搅拌、引流和蘸取溶液。下列实验中至少用到其中两个用途的是(填代号)。
①配制一定物质的量浓度的溶液②硫酸铜晶体里结晶水含量的测定
③用硫酸铜晶体和氢氧化钠溶液制取氧化铜④测定某溶液的pH
⑤从草木灰(主要成分碳酸钾)中提取钾盐⑥浓盐酸与浓氨水相遇发烟
(2)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:取少量 天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由
天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由
 (12分)乙偶姻(F)是一种重要的香料,存在于啤酒中,是酒类调香中一个极其重要的品种。某人工合成乙偶姻的路线如下:
(12分)乙偶姻(F)是一种重要的香料,存在于啤酒中,是酒类调香中一个极其重要的品种。某人工合成乙偶姻的路线如下: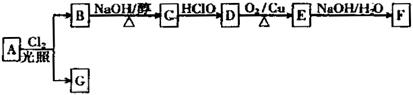
已知:
请回答下列问题:
(1)烷烃A只有2种同分异构体(包括A),则A的分子式是
(2)B和G均为一氯代烃,B发生消去反应时,有C和C′两种有机产物,而G发生消去反应时,只有一种有机产物C′。则C和C′的名称(系统命名)分别为,
(3)反应D→E的化学方程式为
(4)乙偶姻F的结构简式为
(5)任意写出2种能发生水解反应的乙偶姻的同分异构体的结构简式: