在右下图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g。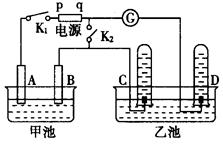
请回答下列问题:
(1)B电极发生反应的电极反应式 。
C电极发生反应的电极反应式 .
(2)甲池电解时反应的离子方程式 。
(3)甲池电解后溶液的c(H+)为 ,要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 g。(假设电解前后溶液的体积不变)
(4)请你设计实验确定甲池原溶液中可能含有的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤、实验现象和实验结论
①假设一: ; ②假设二: 。
②假设二: 。
(5)若再将K1断开,闭合K2,灵敏电流计 中指针是否会发生偏转?理由是什么?
(每空2分共14分)现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl—、SO42-、NO3—的相互分离,实验过程如图所示:
请回答下列问题:
(1)写出实验过程中所用试剂为:
试剂1__________试剂2___________试剂3__________试剂4____________
(2)加入试剂3过量的目的是____________________________________________
(3)操作①的名称是_____________
(4)在加入试剂4后,获得晶体D的实验操作④的名称是_____________
(每空2分共12分)在配制物质的量浓度溶液时,下列操作出现的后果是(填“偏低”“偏高”“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体________________
(2)配制氢氧化钠溶液时,未冷却至室温就转移入容量瓶并定容_____________
(3)配制氢氧化钠溶液时,未洗涤小烧杯和玻璃棒______________
(4)配制氢氧化钠溶液时,容量瓶内残留少量水_____________
(5)配制氢氧化钠溶液时,定容时俯视刻度线______________
(6)配制氢氧化钠溶液时,定容时发现液面超过刻度线,立即用吸管吸出少量水,使液面降至刻度线_______________
钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)工业铝热法炼铁的主要化学反应方程式。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:①铁锅的腐蚀主要是由腐蚀造成的。
②铁锅锈蚀的负极反应式为。
(3)通常使用钢铁是铁和__________的合金;当马口铁(表层镀锡)镀层被损坏后,这时被腐蚀速度比普通铁_______(填“快”或“慢”)。为防止轮船的船体在海水中腐蚀,一般在船身连接(填“锌块”或“铜块”)
Ⅰ保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
⑴pH< 的雨水称为酸雨;向煤中加入适量的,可以大大减少燃物产物中SO2的量。
⑵对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为。
⑶获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为。
Ⅱ(1) (5分) 下列常用物质:
| A.碳酸镁 | B.阿斯匹林 | C.葡萄糖 | D.苯甲酸钠 E.柠檬黄(请用字母填空) |
具有解热镇痛疗效的是,可直接进入人体血液补充能量的是,可用作食品防腐剂的是,常用作食品着色剂的是,常用作治疗胃酸过多的抗酸剂的是。
(2)
①氢氧化铝,小苏打均可防治胃酸分泌过多,其发挥功效时的化学方程式
;。
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)。
③发育出现障碍,患营养缺乏症,这主要是由于摄入蛋白质不足引起的。蛋白质在人体内水解的最终产物是。
A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体化合物。它们按下图所示的关系相互转化,已知A为单质。分别写出有关反应的化学方程式。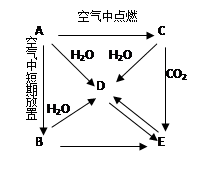
(1)用化学式来表示下列物质:
B:D:E:
(2)写出以下几步反应的化学方程式
A→D:
C→E:
D→E: