有机化合物A--H的转换关系如下所示:
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量为68,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是 ,名称是 ;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)G与金属钠反应 能放出气体,由G转化为H的化学方程式是 ;
能放出气体,由G转化为H的化学方程式是 ;
(4)①的反应类型是 ;
③的反应类型是 ;
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B可能的结构简式 (写一种即可)
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为 。
天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料时的相对投资费用和能量消耗的数据。
| 原料 |
天然气 |
重油 |
煤 |
| 相对投资费用 |
1.0 |
1.5 |
2.0 |
| 能量消耗/J·t-1 |
28×109 |
38×109 |
48×109 |
请回答下列问题。
(1)依据上表信息,你认为采用________为原料最好。
(2)请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
____________________________________________
(3)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g);ΔH=-394 kJ·mol-1①
2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1②
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1③
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式:__________________________________。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_______________________
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应_______________________________
负极反应_______________________________
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
| ① |
Mg 、Al |
稀盐酸 |
偏向Al |
| ② |
Al、Cu |
稀盐酸 |
偏向Cu |
| ③ |
Al、石墨 |
稀盐酸 |
偏向石墨 |
| ④ |
Mg、Al |
NaOH溶液 |
偏向Mg |
| ⑤ |
Al、Zn |
浓硝酸 |
偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验①、②中Al所作的电极是否相同?
答:____________________________________________
(2)写出实验③中的电极名称、电极反应式和电池总反应方程式。铝为( )______________________________
石墨为( )__________________________
电池总反应:__________________________
(3)实验④中的铝作________极。
(4)实验⑤中铝作________极。
(1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,表示生成1 mol H2O的热化学方程式为_________________________
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的标准燃烧热为____________kJ·mol-1,该反应的热化学方程式为_______________________________________________
工业废水中常含有一定量的Cr2O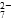 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为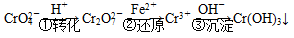
其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O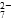 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O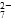 和CrO
和CrO 的浓度相同
的浓度相同
b.2v(Cr2O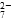 )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O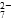 离子,需要______mol的FeSO4·7H2O。
离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O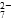 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为______________________________________
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________________,溶液中同时生成的沉淀还有________。