(1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,表示生成1 mol H2O的热化学方程式为_________________________
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的标准燃烧热为____________kJ·mol-1,该反应的热化学方程式为_______________________________________________
根据下面的反应路线及所给信息填空: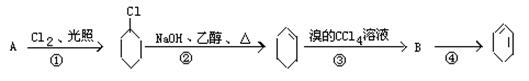
(1) A的结构简式是;
(2) ①的反应类型,②的反应类型,
③的反应类型;
(3) 反应③的化学方程式: ;
;
反应④的化学方程式:。
(12分)A、B、C、D均为含两个碳原子的有机化合物,(相互转化关系如下图)其中D是一种最常见食用有机酸,在反应①的混合液中加过量的稀硝酸后再加硝酸银溶液产生白色沉淀。
(1)写出A的分子式,C、D的结构简式:
A____________________C____________________D_______________________。
(2)写出①②③的方程式:
①:
②:
③:
糖尿病是由于人体内胰岛素紊乱导致的代谢紊化综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动,都会导致糖尿病。
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是
A.葡萄糖分子可表示为Ca(H2O)6,则每个葡萄糖分子含有6个H2O
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测病人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇【结构简式为:CH2 OH(CHOH)3CH2OH】是一种甜味剂,糖尿病人食用后不会导致血糖升高。若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有种同分异构体。
(3)糖尿病人不可饮酒,酒精在肝脏内可转化成有机物A。A的实验结果如下:
①通过实验测得A的相对分子质量为60。
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子的个数比为1:3。
③A可与酒精在一定条件下生成有芳香气味的物质。
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入溶液,发现有气泡冒出;
写出A与酒精反应的化学方程式。
(4)糖尿病人宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质。下列说法正确的是。
A.蛋白质溶液遇碘单质会变蓝色
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含水解纤维素的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质溶液遇浓硝酸变黄,称为蛋白质的显色反应
E.工业上常利用蛋白质的皂化反应来制取肥皂
(12分)A、B、C、D、E是除稀有气体以外的的5种短周期元素,原子序数依次增大并分占三个周期。B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3:4,E原子的电子层数等于最外层电子数。请回答相关问题:
(1)B元素在周期表中的位置_______________,C元素是__________(填元素符号)
(2)比较D和E简单离子半径的大小(用离子符号表示):__________________
(3)A和D形成的含18电子化合物的化学式为___________________
(4)元素E形成的简单离子的水溶液与C的氢化物的水溶液反应的离子方程式为: ________________________________________________
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2A6化合物,该物质在D2中能燃烧,写出它在D2中完全燃烧的化学方程式:_________________________________________
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2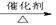 2CH3COOH。
2CH3COOH。
③已知乳酸F的结构简式为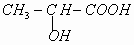 。.
。.
现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示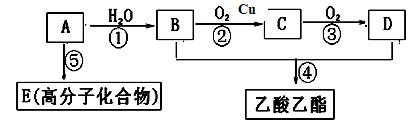
回答下列问题:
(1)E的结构简式为
(2)F分子中含________和_________两种官能团(写名称)
(3)验证D和F兼有的官能团常采用的试剂是,产生的现象为
(4)写出下列反应的反应类型:①,④。
(5)写出下列反应的化学方程式:
①;
②;
③F与金属钠反应的化学方程式为