在淀粉-KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,这是因为⑴___________________________,离子方程式:____________________________;⑵在上述蓝色溶液中滴加足量的Na2SO3溶液,蓝色逐渐消失,这是因为_______________,离子方程式是__________________________________。⑶从以上实验可知ClO-、I2、SO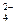 的氧化性由强到弱的顺序是________________________。
的氧化性由强到弱的顺序是________________________。
[化学——选修3: 物质结构与性质]Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出所含有的配位键。其固体分子及气体分子中Sn的杂化方式为。
(3)SnCl4分子的空间构型为,SnCl4与CCl4中
沸点较高的是。
(4)锡的某种氧化物的晶胞如图,其化学式为。
(5)解释白锡分子的密度大于灰锡的密度的原因:。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度为。
(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因_______。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与N 具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。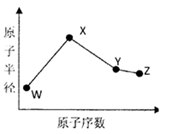
(1)Y在周期表中的位置是。
(2)用电子式表示化合物X3W的结构 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是。
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则ab(填“>”或“<”或“=”)。
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是。
(6)已知W的单质与气体B在一定条件下可形成气体A,即: △H=—92.4kJ·mo1-1
△H=—92.4kJ·mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mo1/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10 min |
3.8 |
8.4 |
0.4 |
| 第20 min |
3.4 |
7.2 |
1.2 |
| 第30 min |
3.4 |
7.2 |
1.2 |
| 第40 min |
3.6 |
7.8 |
0.8 |
①0min~10min,W2的平均反应速率。
②反应在第l0min改变了反应条件,改变的条件可能是。
a.更新了催化剂 b.升高温度 c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是。
a.更新了催化剂 b.升高温度c.增大压强 d.减小A的浓度
香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得: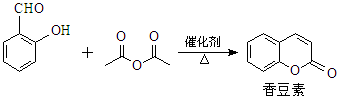
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有2个羟基通常不稳定,易脱水形成醛基。
请回答下列问题:
(1)香豆素的分子式为;
(2)由甲苯生成A的反应类型为;A的化学名称为。
(3)由B生成C的化学反应方程式为;
(4)B的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中只出现四组峰的有种;
(5)D的同分异构体中含有苯环的还有种,其中:
①既能发生银境反应,又能发生水解反应的是(写结构简式)。
②能够与饱和碳酸氢钠溶液反应放出CO2的是(写结构简式)。
选做
(1)写出有机物的系统命名: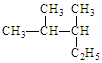 。
。
(2)键线式 表示的分子式为;名称是。
表示的分子式为;名称是。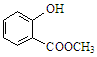 中含有的官能团的名称为。
中含有的官能团的名称为。
(3)丁基的4个结构简式为_______________________。