若NA为阿伏加德罗常数,下列说法中正确的是
| A.常温常压下,11.2LN2和NO的混合气体所含的原子数为NA |
| B.1 mol C8H18分子中,共价键总数为25NA |
| C.在1mol/L碳酸钠溶液中CO32-、HCO3-、离子总数为NA |
| D.含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数为0.2NA |
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,则乙不可能是
| A.H2SiO3 | B.Fe(OH)3 | C.NH4Cl | D.NO2 |
镁—过氧化氢燃料电池具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4==MgSO4+2H2O,结构示意图如图所示。下列关于该电池的叙述正确的是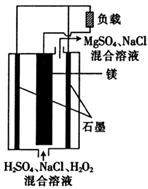
| A.想要实现该反应,电池内部可以使用MnO2作填料 |
| B.电流工作时,H+向Mg电极移动 |
| C.电池工作时,正极的电极反应式为Mg—2e-==Mg2+ |
| D.电池工作时,电解质溶液的pH将不断变大 |
下列热化学方程式中的△H能正确表示物质的燃烧热的是
| A.CO(g)+1/2O2(g) = CO2(g)△H =-283.0 kJ/mol |
| B.C(s) +1/2O2(g) = CO(g)△H =-110.5 kJ/mol |
| C.H2(g) +1/2O2(g) = H2O(g)△H =-241.8 kJ/mol |
| D.2C8H18(l) +25O2(g) = 16CO2(g)+18H2O(l)△H =-11036 kJ/mol |
已知:2Zn(s)+O2(g)=2ZnO(s)△H =-701.0 kJ/mol ①
2Hg(l)+O2(g)=2HgO(s)△H =-181.6 kJ/mol②
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.+519.4 kJ/mol | B.+259.7 kJ/mol |
| C.-259.7 kJ/mol | D.-519.4 kJ/mol |
某可逆反应的△H =" +246" kJ·mol-1,下列有关该反应的叙述正确的是
| A.正反应的活化能比逆反应的活化能大246 kJ/mol |
| B.正反应的活化能一定小于246 kJ/mol |
| C.逆反应的活化能一定大于246 kJ/mol |
| D.逆反应的活化能一定大于正反应的活化能 |