(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
该反应中还原产物是______________________;若反应过程中转移了0.2 电
电
子,则氧化产物的质量是________________________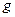 。
。
(2)将过量Cl2 通入 FeBr2溶液中,反应的离子方程式为:________ ________________;
________________;
(3)向NH4HCO3溶液中滴加少量的NaOH溶液,反应的离子方程式为______________;
(4)观察如下反应,总结规律,然后完成下列问题:
Al(OH)3 +H2O Al(OH)4- + H+ NH3+H2O
Al(OH)4- + H+ NH3+H2O NH4+ + OH-
NH4+ + OH-
①已知B(OH)3是一元弱酸,写出其电离方程式_____________________________
②N2H4是二元弱碱,写出其第二步电离方程式___________________ ____
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
⑴该反应的平衡常数表达式为 K = ___________________________。
⑵如图是该反应在不同温度下CO的转化率随时间变化的曲线。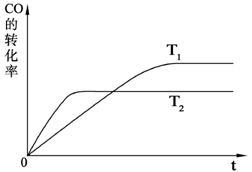
①该反应的焓变△H _____0(填“>”、“<”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是_________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.使用合适的催化剂 | D.充入He,使体系总压强增大 |
⑶已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)△H=-a kJ·mol-1
② 2CO(g) + O2(g) = 2CO2(g)△H=-b kJ·mol-1
③ H2O(g) = H2O(l)△H=-c kJ·mol-1
则CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l)△H= ____________________ kJ·mol-1。
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)△H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g)△H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: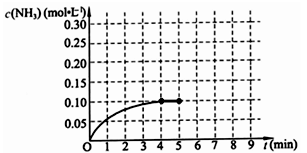
⑴根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)=_________________。
⑵该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。
⑶下列描述中能说明上述反应已达平衡的是___________。
| A.3v正(H2)=2v逆(NH3) |
| B.容器中气体的平均相对分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
⑷第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡_______________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
⑸第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3浓度约为0.25mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
过氧化氢(H2O2)是一种无色粘稠液体,它的水溶液俗称双氧水,呈弱酸性,常用作无公害的消毒杀菌剂和漂白剂等。
⑴下列说法正确的是_________
| A.过氧化氢分子中既有极性键又有非极性键 | B.H2O2与H2O互为同素异形体 |
| C.34g H2O2中含有的阴离子数为NA | D.实验室可以利用过氧化氢制取氧气 |
⑵ H2O2是一种二元弱酸,请写出它的第二步电离方程式:_____________________。
⑶将H2O2溶液加入酸性FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式:_____________________________________。
⑷某厂工业废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式:__________________________________________。
茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: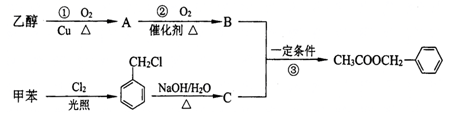
⑴写出反应①的化学方程式:_________________________________________。
⑵反应③的反应类型为:___________________。
⑶写出C中的官能团的名称:___________________。
⑷上述①②③三个反应中,原子的理论利用率为100%、符合绿色化学要求的反应是___________(填序号)。
⑸乙酸苯甲酯有很多同分异构体,含有酯基和一取代苯结构的同分异构体有五个,其中三个的结构简式是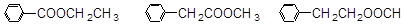
请写出另外两个同分异构体的结构简式:________________和__________________。
(共8分)燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)已知燃料电池的总反应式为CH4 + 2O2 + 2KOH ="=" K2CO3+ 3H2O,电池中有一极的电极反应为CH4 + 10 OH- - 8e- == CO2-3 + 7H2O,这个电极是燃料电池的(填“正极”或“负极”),另一个电极上的电极反应式为:
(2)随着电池不断放电,电解质溶液的碱性(填“增大”、“减小”或“不变”)
(3)通常情况下,甲烷燃料电池的能量利用率(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。