氟在自然界中常以的形式存在。
(1)下列关于的表述正确的是
a.与间仅存在静电吸引作用
b.的离子半径小于,则的熔点高于
c.阴阳离子比为2:1的物质,均与晶体构型相同
d.中的化学键为离子键,因此在熔融状态下能导电
(2)难溶于水,但可溶于含的溶液中,原因是
已知在溶液中可稳定存在。
(3)通入稀NaOH溶液中可生成,分子构型为
(4)与其他卤素单质反应可以形成卤素互化物,例如、等。已知反应 ,键的键能为,键的键能为,则中键的平均键能为
(1)研究硫及其化合物性质有重要意义。
硫酸工业生产中涉及如下反应:
2SO2(g)+O2(g)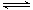 2SO3(g)。
2SO3(g)。
向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系
如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。
温度为T1时,反应的平衡常数K= 。(单位必须写)若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍
b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80%
d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25°C时,Ksp[Mg(OH)2]=5.6×10-12 Ksp(MgF2)=7.4×10-11 。 25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变);
25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变); 在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
(3)Al2(SO4)3溶液显示酸性,其原因是 (写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因: 。
(4)加热蒸发下列溶液,能析出得到原溶质的是
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液 d.盐酸
(5)25°C时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为 。
“嫦娥一号”的登月成功,实现了中国人“奔月”的梦想。
(1)2H2(g)+O2(g)=2H2O(l); H=-571.6kJ·mol-1
H=-571.6kJ·mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ·mol-1
C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l); H="-5518" kJ·mol-1
H="-5518" kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) H =-890kJ·mol-1
H =-890kJ·mol-1
相同质量的H2、C、 C8H18、CH4完全燃烧时,放出热量最多的是 。
(2) 氢气、氧气不仅燃烧能放出热量,二者形成的原电池还能提供电能。“嫦娥一号”绕月飞行部分使用的是氢氧燃料电池,电解质溶液为KOH溶液,其电极反应式为:
负极 ;正极 ;
(3)若用氢氧燃料电池电解100mL由NaCl 和CuSO4组成的混合溶液,其中[Na+]=3[Cu2+]=0.3mol·L-1,用石墨作电极,通电一段时间后,在阴极收集到0.112L H2(标况).
试计算:
①阴极析出Cu mol。阳极析出气体为 (填化学式)。
②若所得溶液仍然为100mL,则此时溶液的pH值为 。
有下列各组物质,请按要求填入序号:
| A.O2和O3 |
B.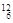 C和 C和 C C |
C.CH2=CH-CH2-CH3和 |
D.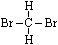 和 和 |
E. 和
和
①_________组两物质互为同位素。②_________组两物质互为同素异形体。③_________组两物质属于同系物。④_________组两物质互为同分异构体。⑤_________组中的物质是同一物质
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是 。
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3OCH3 |
(2)化合物A的分子式是C3H6O,A的核磁共振氢谱图如下图所示,则A的结构简式为: 。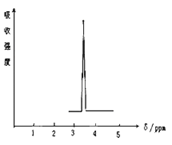
(3)用核磁共振氢谱的方法来研究C2H4Br2的结构,简要说明根据核磁共振氢谱的结果来确定C2H4Br2分子结构的方法是: 。
碘溶于碘化钾溶液中形成I3-,并建立如下平衡:I3-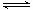 I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度。
I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度。
实验原理:
为了测定平衡时的c(I3-),可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。由于溶液中存在I3-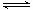 I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
实验内容:
(1)用一只干燥的100 mL 碘量瓶(测量过程中所用的一种密闭玻璃容器)和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
(2)将两只碘量瓶塞好塞子,振荡30分钟,静置。
(3)分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
(4)带入数据计算c(I3—)
试回答下列问题
①标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
②碘量瓶在震荡静置时要塞紧塞子,可能的原因是 。
③滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
④用c 、V1和V2表示c(I3-)为 mol·L-1。
⑤若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3-)
(填“偏大”、“偏小”或“不变”)