(1)下列操作会导致实验结果偏高的是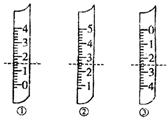
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线。
B.在配制一定物质的量浓度溶液时,用 10 mL的量筒量取5.0 mL液体溶质时俯视读数
C.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
D.10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
E.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度
(Ⅱ)现有下列仪器或用品:a.铁架台(含铁圈、铁夹) b.锥形瓶c.滴定管 d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计。
现有下列试剂:A.NaOH固体 B.碳酸钠溶液 C.氯化镁溶液 D.蒸馏水,试填空:
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是
。
A.①是量简,读数为1.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.50mL
D.②是温度计,读数是2.5℃
(2)配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是
(3)除去 Mg(OH)2中混有的少量 Ca(OH)2,可以用的试剂是: (选填序号),操作方法是 、 洗涤。完成上述操作,上述仪器或用品用到的有 (从上述仪器或用品中选择,并填上相应序号)。
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题: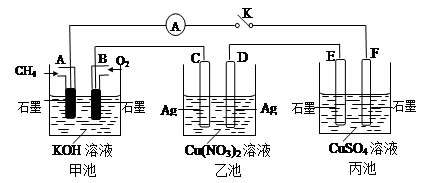
(1)甲池A电极的电极反应式为 。
(2)丙池中电解反应的方程式是 。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是 (填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
用质量分数为98%密度为1.84g·cm-3的浓硫酸配制250mL物质的量浓度为2mol·L-1的稀硫酸。其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸, (简述浓硫酸稀释的操作),冷却
B.检查 (填所用仪器名称)是否漏水
C.用蒸馏水洗涤烧杯和玻璃棒2~3次,将每次的洗涤液都转移入容量瓶里
D.将稀释后的硫酸小心地用玻璃棒引流至容量瓶里
E.盖紧瓶塞,上下倒转摇匀溶液
F.将蒸馏水直接加入容量瓶至刻度线以下2cm处
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到凹液面最低点恰好与刻度线相切
请据此填写:
(1)完成上述步骤中的空白处。
(2)正确的操作顺序是(用字母填写):()→()→()→()→()→()→()
(3)进行A步操作时,选用量筒的规格是 。(选填字母)
A.10mL B.50mL C.100mL D.1000mL
(4)下列情况对所配制的稀硫酸浓度有何影响?(选填“偏高”、“偏低”、“无影响”)。
①.用量筒量取浓硫酸时俯视,则 ;
②.A 步操作时,浓硫酸稀释后,未冷却即进行下一步操作,则_________;
③.定容时仰视溶液的凹液面,则_________。
海洋植物如海带.海藻中含有丰富的碘元素,其主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:(已知: 2I—+ Cl2=2Cl—+I2)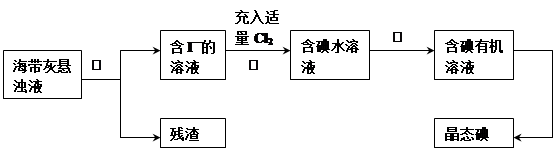
(1) 指出提取碘的过程中有关的实验操作名称:① ,③ ;
(2) 过程②中充入适量Cl2的目的是 ;
(3) i)操作③中所用的有机试剂可以是 (填代号)
A.乙醇(与水互溶) B.四氯化碳 C.甲烷气体 D.食盐水
ii)简述要把碘水变成碘有机溶液对于提取晶体碘的优点 。
(4) 操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E. ;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(a) 过程③的操作顺序是 C、 B、 D、 A、 H、 G、 E、 F,则E的操作步骤是 ;
(b) 上述G步操作的目的是: ;
(c) 最后碘的有机溶液是通过 获得(填“漏斗上口”或“漏斗下口”)。
右图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度是 mol/L。
(2)取用任意体积的浓盐酸时,下列物理量不随所取体积的多少而变化的是 。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
| C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生用上述浓盐酸和蒸馏水,配制250mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。如果实验室有5mL、10mL 、20mL、50mL量筒,应选用 mL量筒最好。
② 需要使用的实验仪器有:烧杯、玻璃棒 、量筒 、胶头滴管和 。
③配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填写偏大、偏小或无影响)
i)用量筒量取浓盐酸时俯视观察凹液面 。
ii)定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 。
实验室配制500 mL 0.2 mol·L-1的Na2SO4溶液,实验操作步骤有 :
| A.在天平上称出14.2 g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。 |
| B.把制得的溶液小心地转移到容量瓶中。 |
| C.继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。 |
| D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。 |
E.将容量瓶瓶塞塞紧,反复上下颠倒,摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)______________。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是________、________、________。
(3)下列情况会使所配溶液浓度偏高的是(填序号)________。
a.某同学观察液面的情况如图所示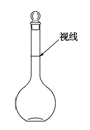
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠