(一) 欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)应称取 g Na2CO3·10H2O。
(2)配制该溶液所用的仪器有 ____ 。
(3)下列操作使所配溶液浓度偏低的是( )
| A.容量瓶未干燥即用来配制溶液 | B.往容量瓶转移溶液时有少量液体溅出 |
| C.未洗涤溶解固体的烧杯 | D.定容时,仰视刻度线 |
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷。
已知:
①反应原理:NaBr+H2SO4(较浓)△="==" NaHSO4+HBr
HBr+C2H5OHC2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
| |
密度/g·mL-1 |
沸点/℃ |
溶解性 |
| 溴乙烷 |
1.461 |
38 |
难溶于水 |
| 乙醇 |
0.789 |
78 |
易溶于水 |
回答下列问题:
(4)连接上述仪器的顺序是:1接( )接( )接( 4 )接( 3 )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是 (写化学式),除去该杂质的试剂和方法是 ,为了减少该副产物的生成,根据加入的反应物,本实验采取了 _________________________________________________________的措施。
某课外小组利用H2还原CuO粉末测定铜元素的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸,C中试剂是稀氢氧化钠溶液。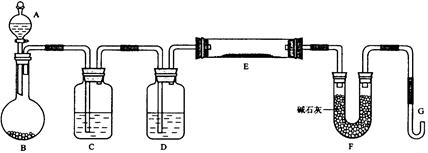
请回答下列问题。
(1)仪器中装入的试剂:B、D。
(2)装置C的作用是。
(3)连接好装置后应首先。
(4)“①加热反应管E”和“②从A瓶逐滴滴加液体”这两步操作应该先进行的是(填序号)。在这两步之间还应进行的操作是。
(5)反应过程中G管逸出的气体是,其处理方法是。
(6)从实验中测得了下列数据:
①空E管的质量a;②E管和CuO的总质量b;
③反应后E管和Cu粉的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e。
由以上数据可以列出计算Cu的相对原子质量的两个不同计算式(除Cu外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(Cu)=;计算式2:Ar(Cu )=。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1)①~⑥中发生化学变化的有。
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(3)步骤⑤中所使用玻璃仪器的名称是。该小组选择用苯来提取碘的理由是。
(1)除去KCl溶液中的K2SO4,依次加入的试剂是(填化学式),按实验操作顺序发生的第一个反应的化学方程式为。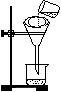
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为:
 |
回答下列问题:
①操作A所需的仪器有;
②操作B的名称是;
③过滤步骤的装置和操作如图所示,指出图中的两处错误:
;
。
天然碱是一种重要的矿物质,盛产于我国的青海湖地区。某天然碱样品的成分可以看成是碳酸钠、碳酸氢钠和水按物质的量之比1:1:2形成的结晶水合物。请回答下列问题:
(1)这种天然碱中碳酸钠、碳酸氢钠和水三者的质量比为。
(2)45.2 g此天然碱与100 mL密度为1.1 g/cm3的中等浓度盐酸恰好完全反应,产生a mol CO2,则a=,盐酸中溶质的质量分数ω(HCl)=%。
(3)用一个化学方程式表示该天然碱与盐酸的反应:
。
(1)甲烷(CH4)的摩尔质量为;
(2)8 g CH4中约含有个分子、含有mol电子,在标准状况下所占的体积约为L;
(3)所含原子数相等的甲烷和氨气(NH3)的质量比为。