黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫、铁的化合物。
(1)黄铜矿的组成元素中,属于副族元素的是__________(填写名称,下同);属于主族元素的是_____,它位于周期表的位置是__________,它的原子半径________Cl的原子半径(填“>”、“<”或“=”,下同),它的气态氢化物的稳定性____HCl。
(2)冶炼铜的反应为8CuFeS2+21O2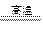 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号),氧化产物是___________(填化学式)。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程:① (请配平),②S2O82-+2Fe2+=2SO42-+2Fe3+。
物质A~K都是由下表中离子形成的,且为中学化学常见物质,有如图所示的转化关系。部分产物中的水已省略。(如果需要阴、阳离子可以重复使用)
已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸。试按要求回答下列相关问题:
(1)A、D、J的化学式为:A、D、J;
(2)相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是(用化学式表示);
(3)写出反应③的离子方程式:
(4)用惰性电极电解I溶液阳极的电极反应方程式为:
下图每一方框中的字母代表一种反应物或生成物:产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为:。
(2)F的化学式为:。
(3)写出J受热分解反应的化学方程式:。
(4)E的溶液呈酸性的原因(用离子方程式表示) ________________________。
(5)H和G之间反应的化学方程式为:________________________________。
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)
和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随
c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-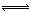 Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率下降的原因是

如图所示,已知G 、A分别是海水中含量最多的两种化合物,E是“84”消毒液的主要成分具有漂白性,请回答以下问题
(1)分别写出A、C、D、F、E的电子式:A 、C 、
D 、F 、E
(2)电解G 、A的混合物阴极上的电 极反应式为
极反应式为
若同时在两电极附近各滴入几滴酚酞试液,阴极附近观察到的现象是 ;
阳极上的电极反应式为 ,检验该电极反应产物的方法是 。
(3)C和D反应可以生成一种强酸盐和生成一种弱酸盐写出方程式
该弱酸盐具有 性,常用于杀菌消毒。
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答: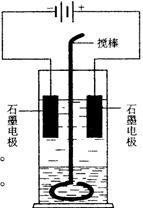
(1)阳极上的电极反应式为________________________________。
(2)阴极上的电极反应式为_____________________ ___________。
___________。
(3)原上层液体是________________________________________。
(4)原下层液体是________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是__________________。