I.化工工业中常用乙苯脱氢的方法制备苯乙烯。
已知某温度下:
反应①:CO2 (g) +H2 (g)→CO(g) + H2O(g),ΔH =" +41.2" kJ/mol;
反应②: 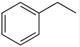 (g)→
(g)→ (g)+H2(g),ΔH=" +117.6" kJ/mol;
(g)+H2(g),ΔH=" +117.6" kJ/mol;
①②的化学反应平衡常数分别为K1、K2,
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 ,该反应的化学平衡常数K= (用K1、K2表示)
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是
| A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小; |
| B.若再加入1molCO2、1mol H2,平衡不移动; |
| C.若再加入CO2则平衡向正反应方向移动,CO的体积分数减小; |
| D.若充入He,平衡不移动,反应物和产物的浓度都不变; |
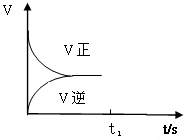
(3)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。
II.一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
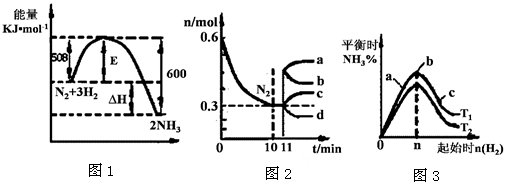
(4)升高温度,该反应的平衡常数 (填“增大”或“减小”或“不变”)。
(5)由图2信息,计算10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
(6)图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素价电子的电子排布式为,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fen再失去一个电子难。其原因是。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是,写出一种与 CN-互为等电子体的单质分子的电子式。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为。
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为。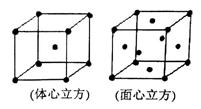
海洋是一个巨大的化学资源宝库,下图是海水加工的示意图: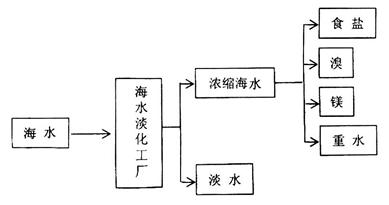
(1)海水淡化工厂通常采用的制备淡水的方法有(写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式,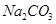 溶液中发生反应的化学方程式为。
溶液中发生反应的化学方程式为。
(3)制备金属镁是通过电解熔融的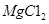 ,而不用MgO,其原因是
,而不用MgO,其原因是
。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是。
已知HA是一种弱酸。请回答下列问题:
(1)现有一种含有HA和其钠盐NaA的溶液。
①组成该溶液的微观粒子有;
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是;
③若向该溶液中逐滴加入NaOH溶液时,下列图像能表示 离子数目变化趋势的是(填字母)。
离子数目变化趋势的是(填字母)。
(2)现将1体积0.04mol 溶液和1体积0.02mol
溶液和1体积0.02mol NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。
①若该混合液显碱性,则其 0.01 mol
0.01 mol (填“<”、“=”或“>”);
(填“<”、“=”或“>”);
②若该混合液显酸性,则溶液中所有离子的浓度由大到小的顺序是。
氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① =
= mol
mol
② =
= mol
mol
③ =
= mol
mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式。
(2)生产甲醇的原料CO和H2来源于下列反应:
①一定条件下 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则
 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数( )的大小关系为;
)的大小关系为;
②100℃时,将1 mol  和2 mol
和2 mol  通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是(填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是(填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.
如果达到平衡时 的转化率为0.5,则100℃时该反应的平衡常数K=。
的转化率为0.5,则100℃时该反应的平衡常数K=。
(3)某实验小组利用CO(g)、 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为。
新型材料纳米级Fe粉具有超强的磁性,能用作高密度磁记录的介质以及高效催化剂等。
I.实验室采用气相还原法制备纳米级Fe,其流程如下: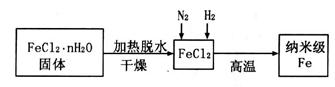
(1)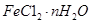 固体加热脱水通常要通入。
固体加热脱水通常要通入。
(2)生成纳米级Fe的化学方程式为。
Ⅱ.在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成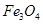 。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。
。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。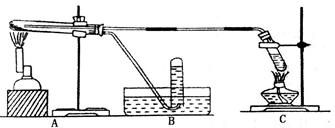
(3)B中收集到的气体是(填名称),C装置的作用是。
(4)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
乙同学认为该条件下反应的固体产物为FeO。丙同学认为该结论不正确,他的理由是(用离子方程式表示)。
(5)丁同学称取5.60gFe粉,反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗0.08molFeCl3。丁同学实验的固体产物为。