Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素价电子的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fen再失去一个电子难。其原因是 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是 ,写出一种与 CN-互为等电子体的单质分子的电子式 。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为 。
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。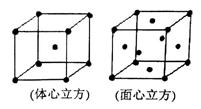
在世纪之交,罗马尼亚的炼金废水汇入尼罗河,导致大量鱼类等水生物死亡,造成世界级 的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结
的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结 合时生成剧毒的HCN。完成下列问题:
合时生成剧毒的HCN。完成下列问题:
(1)HCN的水溶液酸性很弱,其电离方程式为_________________,NaCN的水溶液呈碱性是因为_________________(用离子方程式表示)。
(2)室温下,如果将0.1mol NaCN和0.05mol HCl全部溶于水,形成混合溶液(假设无损失),
①___和___两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比H+多0.05mol。
在25℃时,用石墨电极电解2.0 L,2.5 mol/L CuSO4溶液,如有0.2 mol电子发生转移,试回答下列问题:
⑴电解后得到的Cu的质量是,得到O2的体积(标准状况)是,溶液的pH是。
⑵如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差,电解液的pH(填“变小”、“变大”或“不变”)
将等物质的量A、B气体,置于容积为2L的密闭容器中发生反应,当反应进行到8s末,达到该反应的限度,测得A的物质的量减少0.6mol,B的物质的量减少0.2mol,C的物质的量增加0.4mol,此时n(A):n(B):n(C)=1:2:1。
则:
(1)该反应的化学方程式为:;
(2)用生成物C表示的该反应的速率为:;
(3)反应前A、B的物质的量浓度是:。

(1)已知 A、B、C、D是中学化学中常见的四种不同
A、B、C、D是中学化学中常见的四种不同 微粒,它们之间存在如图所示的转化关系.如果A、B是
微粒,它们之间存在如图所示的转化关系.如果A、B是 10电子离子,C、D是10电子分子,A、B、C、D均含有
10电子离子,C、D是10电子分子,A、B、C、D均含有 两种元素.请写出A、B、C、D四种不同微粒的化学式:
两种元素.请写出A、B、C、D四种不同微粒的化学式: A、B、
A、B、 C、D.
C、D.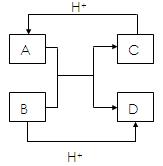
(2)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Zn + CuCl2 = ZnCl2+ Cu
①根据两反应本质,判断能否设计成原电池(A)(B)
②如果能,实验结束后,称得两极质量差为12.9g,则转移电子的物质的量为__________.
③如果不能,说明其原因
(9分)下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(2) 最高价氧化物对应水化物酸性最强的化合物是__________;(填写分子化学式)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子反应方程式:
_____________________,___________________________;
(4)比较⑦、⑩单质氧化性的强弱:__________________________。