氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① =
= mol
mol
② =
= mol
mol
③ =
= mol
mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)生产甲醇的原料CO和H2来源于下列反应:
①一定条件下 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则
 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数( )的大小关系为 ;
)的大小关系为 ;
②100℃时,将1 mol  和2 mol
和2 mol  通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.
如果达到平衡时 的转化率为0.5,则100℃时该反应的平衡常数K= 。
的转化率为0.5,则100℃时该反应的平衡常数K= 。
(3)某实验小组利用CO(g)、 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。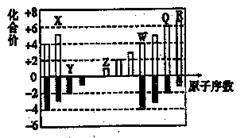
(1)元素Q位于周期表中第周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。
阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
(1)反应①为取代反应,该步反应物Me2SO4中的“Me”表示,D中官能团的名称是。
(2)写出E的结构简式:。
(3)G能发生的反应类型是(填字母序号)
| A.取代反应 | B.酯化反应 | C.加聚反应 | D.还原反应 E.加成反应 |
(4)写出F在NaOH溶液中反应的化学方程式:。
(5)写出所有满足下列条件的B的同分异构体:。
①只含有一个环(既苯环)的芳香族化合物;②核磁共振氢谱中氢峰的个数相比B的其它同分异构体最少。
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铭铁矿粉碎的作用是
(2)步骤③调节pH后过滤得到的滤渣是。
(3)操作④中,酸化时,CrO2- 4转化为Cr2O2- 7,写出平衡转化的离子方程式
;
(4)用简要的文字说明操作⑤加入KCl的原因。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O2- 3=2I- +S4O2- 6)
①判断达到滴定终点的依据是;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)(保留2位有效数字)。
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min |
0 |
1 |
2 |
3 |
4 |
6 |
8 |
| c(X)/(mol·L-1) |
0.60 |
0.42 |
0.30 |
0.21 |
0.15 |
a |
0.0375 |
(1)3min时用Z表示的平均反应速率v(Z)=。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是。由此规律推出反应在6min时反应物的浓度a为mol·L-1。
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是、(填写两顶)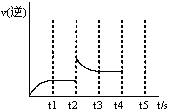
(4)下列哪些情况表明容器中已达平衡状态(填字母序号)
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍
下表给出了五种元素的相关信息,其中w、X、Y、Z为短周期元素,原子序数依次递增。
| 元素 |
相关信息 |
| W |
单质为密度最小的气体 |
| X |
元素最高正价与最低负价之和为0 |
| Y |
工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z |
存在质量数为23,中子数为12的核素 |
| T |
金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
根据上述信息填空:
(1)元素Y在元素周期表中的位置是。XY2由固态变为气态所需克服的微粒间作用力是。
(2)化合物甲是一种强氧化剂,由元素Y和Z组成,写出甲的化学式:,
(3)化合物乙由元素W和X组成,乙是同时含极性共价键和非极性共价键的相对分子质量最小的分子。在25℃、101kpa下,已知2g的气体乙在Y2气体中完全燃烧后恢复至原状态,放热QkJ,该燃烧反应的热化学方程式是。
(4)化合物丙仅由W、X、Y、Z、T中的四种元素组成,四种元素的质量比为1:6:40:64,化合物丙中含有两种阴离子,写出燃烧丙的化学方程式。