下表给出了五种元素的相关信息,其中w、X、Y、Z为短周期元素,原子序数依次递增。
| 元素 |
相关信息 |
| W |
单质为密度最小的气体 |
| X |
元素最高正价与最低负价之和为0 |
| Y |
工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z |
存在质量数为23,中子数为12的核素 |
| T |
金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
根据上述信息填空:
(1)元素Y在元素周期表中的位置是 。XY2由固态变为气态所需克服的微粒间作用力是 。
(2)化合物甲是一种强氧化剂,由元素Y和Z组成,写出甲的化学式: ,
(3)化合物乙由元素W和X组成,乙是同时含极性共价键和非极性共价键的相对分子质量最小的分子。在25℃、101kpa下,已知2g的气体乙在Y2气体中完全燃烧后恢复至原状态,放热QkJ,该燃烧反应的热化学方程式是 。
(4)化合物丙仅由W、X、Y、Z、T中的四种元素组成,四种元素的质量比为1:6:40:64,化合物丙中含有两种阴离子,写出燃烧丙的化学方程式 。
(4分)小苏打是厨房里的常见物质,是发酵粉的主要成分,请 写出小苏打的化学
写出小苏打的化学
式,若食盐中可能混入了少量小苏打,用下列厨房中的进行检验。
A .白酒 B.食醋 C.酱油 D.白糖
.白酒 B.食醋 C.酱油 D.白糖
从环己烷可制备1,4环己二醇的二醋酸酯,下面是有关的化学反应过程(其中的无机物均已略去)。回答下列有关问题。
(1)反应②的类型是______________,反应⑧的类型是_____________。
(2)反应④的条件、试剂是
(3)写出B、C的结构简式:B________________; C_____________________
(4)写出反应②⑤的化学方程式_________________________________ _________________________________________________________。
在一定条件下,某些不饱和烃分子之间可以发生自身加成反应,如: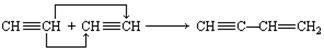
有机物甲的结构简式为: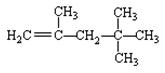 它是由不饱和烃乙的两
它是由不饱和烃乙的两
个分子在一定条件下自身加成而成得到的。在此反应中除生成甲外,还得到另一种产量更多的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体。则乙和丙的结构简式分别为:
___________________________, ___________________________。
烷基取代苯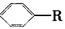 可以被KMnO4酸性溶液氧化生成
可以被KMnO4酸性溶液氧化生成 ,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被
,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被 氧化得到
氧化得到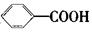 。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为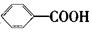 的同分异构体共有7种,其中的3种是:
的同分异构体共有7种,其中的3种是:
请写出其他的4种结构简式、、
、。
高分子化合物和我们人类的生活密切相关。
(1)请写出下列高分子化合物的单体。
①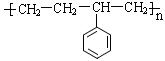 _________________________
_________________________
② ________________________
________________________
(2)腈纶(人造羊毛)的主要成份是聚丙烯腈(丙烯腈:CH2=CH—CN),由乙炔和氢氰酸(HCN)生产聚丙烯腈所涉及的有机化学反应方程式为:__________ ___________、_________。