(12分)[物质结构与性质]
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域。下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程。
(1)Ti基态的电子排布式为 。
(2)TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃。
固态TiCl4属于 晶体。
(3)BaCO3为离子化合物。CO32-中C原子的杂化类型为 ,写出一种与CO32-互为等电子体的阴离子:
(填化学式)。
(4)钛酸钡的晶胞如图所示,其化学式为 。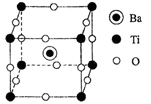
(5)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2•H2O。1mol该配合物中含有σ键的数目为 。
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2 CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
| 实验 序号 |
温度℃ |
初始CCl4浓度 (mol·L—1) |
初始H2浓度(mol·L—1) |
CCl4的平衡转化率 |
| 1 |
110 |
1 |
1.2 |
A |
| 2 |
110 |
1 |
1 |
50% |
| 3 |
100 |
1 |
1 |
B |
(1)此反应在110℃时平衡常数为。
(2)实验l中,CCl4的转化率A50%(填“大于”、“小于”或“等于”)。
(3)实验3中,B的值(选填序号)。
A.等于50%B.大于50%
C.小于50% D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。在图中的四条线中,表示H2起始浓度为2mol·L一1实验的消耗CCl4的百分率变化曲线是 ________(选填序号)。
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1 ;平衡常数为K1 ;
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g)ΔH=+1160 kJ·mol-1 ;平衡常数为K2 。
请回答下列问题:
(1)反应CH4 +2NO2 N2+CO2+2H2O(g) 的平衡常数K=(用K1、K2表示)。
N2+CO2+2H2O(g) 的平衡常数K=(用K1、K2表示)。
(2)若用标准状况下4.48LCH4还原NO2至N2 ,整个过程中转移的电子总数为(阿伏伽德罗常数用NA表示),放出的热量为kJ。
下图烧杯中都盛有稀硫酸,则:
(1)A中进行的离子反应方程式为。
(2)B中负极反应式:;溶液的pH___________(填入增大、减小或不变)。
(3)C中被腐蚀的金属是,正极反应式为。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是。
(5)某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是()
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则甲烷燃烧的热化学方程式为。
(2)科研人员新近开发出一种由甲醇(CH3OH)和氧气以及强碱做电解质溶液的新型手机电池,可供手机连续使用一个月才充一次电,据此请回答以下问题:
A、甲醇在(正或负)极上发生反应,电极反应式为。
B、电池反应的离子方程式:。
填写下列空白:
(1)在戊烷的各种同分异构体中,A不能由某种烯烃和氢气加成获得,其结构简式为。
(2)B是苯的同系物,分子式为C9H12,一溴代物只有2种,则B的结构简式 为 。
(3)氯代烃C的分子式为C4H9Cl,在NaOH乙醇溶液中加热可获得两种沸点不同的烯烃,则C的结构简式为(不考虑顺反异构)。
(4)写出由1,2—二溴乙烷制取乙炔的总化学反应方程式__________________________。