新型材料纳米级Fe粉具有超强的磁性,能用作高密度磁记录的介质以及高效 催化剂等。
I.实验室采用气相还原法制备纳米级Fe,其流程如下: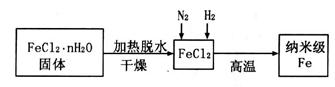
(1)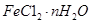 固体加热脱水通常要通入 。
固体加热脱水通常要通入 。
(2)生成纳米级Fe的化学方程式为 。
Ⅱ.在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成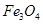 。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。
。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。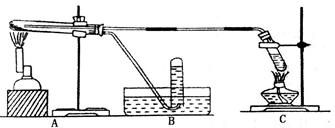
(3)B中收集到的气体是 (填名称),C装置的作用是 。
(4)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
乙同学认为该条件下反应的固体产物为FeO。丙同学认为该结论不正确,他的理由是 (用离子方程式表示)。
(5)丁同学称取5.60gFe粉,反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗0.08molFeCl3。丁同学实验的固体产物为 。
i已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,A的相对分子质量小于30,在下图变化中,F为高分子化合物,C中含有-CHO,E有水果的香味(反应条件未写出)
⑴ B中所含官能团名称 E 物质的名称
⑵ 反应①类型为
⑶ 写出下列反应的化学方程式(注明反应条件)
② ③
ⅱ 一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为 g.
ⅲ有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如下图所示。
(1)B中的含氧官能团名称是。
(2) A→C的反应类型是;A~D中互为同分异构体的是。
(3)由A生成C的化学方程式是。
(4)C在一定条件下发生加聚反应的化学方程式是。
:如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应: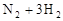

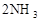 (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:
(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题: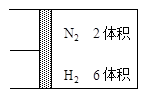
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:
①若a=1,c=2,则b=_________。在此情况下,反应起始时将向_________(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的取值范围是_________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_________,原因是_________。
(8分)甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g)ΔH1②CO2(g)+3H2(g)
CH3OH(g)ΔH1②CO2(g)+3H2(g) CH3OH(g) + H2O(g)ΔH2
CH3OH(g) + H2O(g)ΔH2
已知:③2H2(g)+ O2(g) = 2H2O(g)ΔH3。则2CO(g)+O2(g)=2CO2(g) 的反应热
ΔH=______(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g)ΔH4。
CO(g) + 3H2(g)ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH(填增大、减小、不变)。负极的电极反应式为_______ ____。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是;阴极材料是;阳极泥为:
(8分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4的燃烧热化学方程式是。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:负极的电极反应式是。
(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,充电时:阳极反应式:用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
2PbSO4+2H2O,充电时:阳极反应式:用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
下图为周期表中的一部分。已知A、B、C、D均为短周期元素,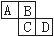
A与D原子序数之和为C原子序数的1.5倍。
(1)B元素符号是: _______、D在元素周期表中第_______族。
(2)四种元素中原子半径最大的是(填元素符号)_______,B、C、D三种离子中半径最大的是(填离子符号)_______。
(3)B比C的氢化物的沸点高是因为_______;A、D两元素的气态氢化物相互反应的生成物的电子式:,其中存在_______键、_______(填“极性”或“非极性”)共价键。
(4)写一个离子方程式证明C和D的非金属性相对强弱:。