i已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,A的相对分子质量小于30,在下图变化中,F为高分子化合物,C中含有-CHO,E有水果的香味(反应条件未写出)
⑴ B中所含官能团名称 E 物质的名称
⑵ 反应①类型为
⑶ 写出下列反应的化学方程式(注明反应条件)
② ③
ⅱ 一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为 g.
ⅲ有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如下图所示。
(1)B中的含氧官能团名称是 。
(2) A→C的反应类型是 ;A~D中互为同分异构体的是 。
(3)由A生成C的化学方程式是 。
(4)C在一定条件下发生加聚反应的化学方程式是 。
利用从冬青中提取的有机物A合成抗结肠炎药物Y及其他化学品,合成路线如下: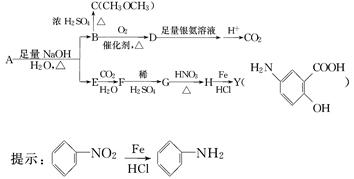
根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是________,B―→C的反应类型是________.
(2)写出A生成B和E的化学反应方程式____________________________________
________________________________________________________________________.
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成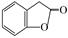 和
和 ,鉴别I和J的试剂为________.
,鉴别I和J的试剂为________.
下图是以苯酚为主要原料制取冬青油和阿司匹林的过程:
(1)写出①、②、③步反应的化学方程式(是离子反应的写离子方程式)
①________________________________________________________________________.
②________________________________________________________________________.
③________________________________________________________________________.
(2)B溶于冬青油致使产品不纯,用NaHCO3溶液即可除去,简述原因________________________________________________________________________.
(3)在(2)中不能用NaOH也不能用Na2CO3,简述原因
________________________________________________________________________.
(4)1 mol 阿司匹林最多可与________ mol 氢氧化钠发生反应.
根据下图所示的反应路线及信息填空:
(1)A的结构简式是________;名称是________
(2)①的反应类型是________;③的反应类型是________.
(3)反应④的化学方程式是______________________________________.
有以下一系列反应,最终产物为草酸. 已知B的相对分子质量比A大79,试推测用字母代表的化合物的结构简式.
已知B的相对分子质量比A大79,试推测用字母代表的化合物的结构简式.
C是____________________________;
F是____________________________.
《茉莉花》是一首脍炙人口的江苏民歌.茉莉花香气的成分有多种, 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和
乙醇为原料进行人工合成.一种合成路线如下: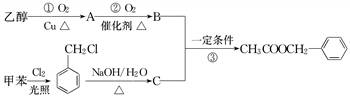
(1)写出反应①的化学方程式:__________________________________________.
(2)反应③的反应类型为______________________________________________.
(3)反应________(填序号)原子的理论利用率为100%,符合绿色化学的要求.
(4)C的结构简式为__________________________________________________,
C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)________________________________.