:如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应: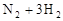

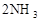 (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:
(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题: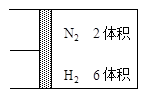
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:
①若a=1,c=2,则b=_________。在此情况下,反应起始时将向_________(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的取值范围是_________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_________,原因是_________。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:_________________________________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1?______(选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是______酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是____________。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+) - c(A-)= ____________mol·L-1;
c(OH-) -c(HA)= ____________mol·L-1。
密闭容器中mA(g)+nB(g)  pC(g),反应达到平衡,经测定增大压强P时,
pC(g),反应达到平衡,经测定增大压强P时,
A的转化率随P而变化的曲线如图。
则:(1)增大压强:A的转化率,平衡向 移动,达到平衡后,混合物中C的质量分数_____。
(2)上述化学方程式中的系数m、n、p的正确关系是。
(3)降低温度,C的质量分数增大,则:平衡向 移动,A的转化率,正反应是 热反应。(以上各空用适当的化学用语或关系式填写)
(1)物质的量浓度均为0.1 mol/L的下列溶液:①NH4Cl、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH,pH由大到小的顺为: (填数字代号)
(2)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为__________________________________。
(3)常温下,0.1 mol/L的NaHCO3溶液的pH大于8,则溶液中H2CO3____ CO32-(填>、=或<),原因________________________(用离子方程式和必要的文字说明)
(4)常温下,pH=a某强酸溶液V1 L,pH=b某强碱溶液V2 L,已知a+b=12,两溶液混合后pH=7,求V1 和V2的关系
(5)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)="________"
(6)常温下,已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中的Mg2+浓度为mol·L-1
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、NaCl等混合组成,为了检验它们所含的物质,做了以下实验: ①将固体溶于水,搅拌后得到无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
③过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解。
(1)试判断:固体混合物中肯定含有,肯定没有;
(2)对可能有的物质,可采用往滤液中滴加(填试剂名称)来检验;
(3)写出③中涉及的化学方程式。
取1.43g Na2CO3·XH2O 溶于水配成10mL 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mL CO2(标准状况)。
计算:(1)稀盐酸物质的量浓度为;
(2)Na2CO3·xH2O的摩尔质量;
(3)x=;