取1.43g Na2CO3·XH2O 溶于水配成10mL 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mL CO2(标准状况)。
计算:(1)稀盐酸物质的量浓度为 ;
(2)Na2CO3·xH2O的摩尔质量 ;
(3)x= ;
F是新型降压药替米沙坦的中间体,可由下列路线合成: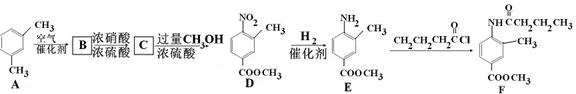
(1)反应类型: D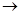 E:___ _,E
E:___ _,E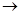 F:____。
F:____。
(2)写出满足下列条件的B的所有同分异构体 __________ (写结构简式)。
①含有苯环②含有酯基③能与新制Cu(OH)2反应
(3)C中含有的官能团名称是 ________________________。已知固体C在加热条件下可溶于甲醇,下列C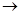 D的有关说法正确的是。
D的有关说法正确的是。
a、D的化学式为C9H9NO4
b、浓硫酸的吸水性可能会导致溶液变黑
c、甲醇既是反应物,又是溶剂
(4)E的同分异构苯丙氨酸经缩聚反应形成的高聚物是 ____(写结构简式)。
(5)F在强酸和长时间加热条件下发生水解反应的化学方程式是 _____。
已知有机物A分子中有3个碳原子,有关它的某些信息注明在下面的示意图中: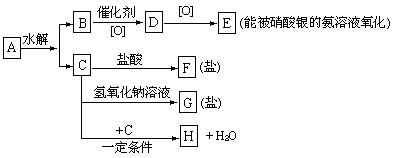
(1 )A、F、G的结构简式为:___________,____________,______________.
(2) 生成H的化学方程式为:__________________________________.
某学生取18g淀粉溶于水,为测定淀粉的水解百分率,其程序如图: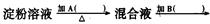
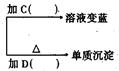
(1)各步所加试剂为:A、B、C、D。
(2)只加A溶液而不加B溶液是否可以,理由。
(3)当析出2.16g沉淀时,淀粉水解率为。
已知下列热化学方程式:①2H2(g) +O2(g)=2H2O(l);ΔH= -570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g) ΔH= -483.68 kJ·mol-1
③2C(s) +O2(g)=2CO(g) ΔH=-221 kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热为;C的燃烧热为。
(2)燃烧10gH2生成液态水,放出的热量为。
(3)写出CO燃烧的热化学方程式。
(4分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应燃烧的热化学方程式是
____________________________________________________
(2)如图是298 K时N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:_________________________________。