海洋是一个巨大的化学资源宝库,下图是海水加工的示意图: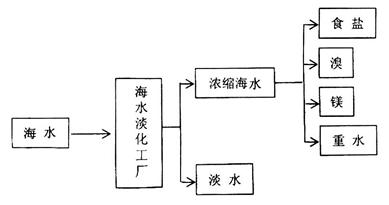
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式 ,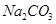 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。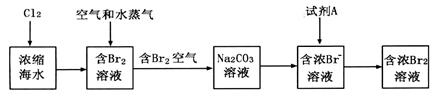
(3)制备金属镁是通过电解熔融的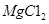 ,而不用MgO,其原因是
,而不用MgO,其原因是
。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是 。
现有NaCl、Na2O2、NaHCO3和Na2SiO3等多种重要的化合物。请用化学式填空:
(1) 常作为潜水艇和呼吸面具中氧气来源的淡黄色固体是;
(2) 常用于焙制糕点,也可用作抗酸药的是;
(3) 可用于制备硅胶和木材防火剂的是。
现有
| A.二氧化硅 | B.三氧化二铁 | C.二氧化硫 | D.三氧化二铝。请你根据已有的知识,选择合适的物质,用字母代号填空: |
(1)能形成酸雨的是;(2)光纤制品的基本原料;
(3)属于两性氧化物的是;(4)红棕色固体是。
(本题共12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题: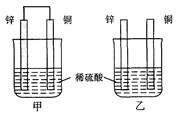
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的c(H+)均增小 |
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________。
(本题共8分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以制取乙酸乙酯。回答下列问题:
(1)浓硫酸的作用是:。
(2) 若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(3) 饱和碳酸钠溶液的主要作用是。
(4)写出制取乙酸乙酯的化学反应方程式。
(5) 生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度相等
⑥反应不再继续进行
(本题共10分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
请回答下列问题:
(1)A物质的名称为________。
(2)C与D在高温下的反应在冶金工业上称为反应,化学方程式为________,引发该反应的实验操作是________________________。
(3)G→J的化学方程式为_________________________________。
(4)A→H的离子方程式为____________________________________。