电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: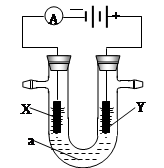
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
(3)若要在铁制品表面镀上一层银,则可选用 溶液为电解液,
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②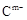 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④ A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④ A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2)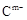 、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为:
_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:2混合,写出该反应的离子方程式。该溶液的溶质含有的化学键类型是
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为______________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是__________________________________,
用电子式表示化合物B的形成过程:_______________________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素
同周期,则反应①的化学方程式为___________________________________。
(3)同族非金属元素之间相互置换的一般是第ⅣA、第ⅥA、第ⅦA。
I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质[ |
元素编号 |
|||||
| ① |
② |
③ |
④ |
⑤ |
⑥ |
|
| 原子半径/nm |
0.102 |
0.110 |
0.074 |
0.075 |
0.071 |
0.099 |
| 最高化合价 |
+6 |
+5 |
+5 |
+7 |
||
| 最低化合价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
A、B、C、D、E五种元素在周期表里的位置如下表所示:
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。
C元素名称是 ,D的最高价氧化物对应水化物的化学式 ,实验室制取单质E的化学方程式 。
4g D2和20g 18O的单质化合时最多能生成g D2O, 1mol D2O中含_______mol质子,含 mol中子。