5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。(本题共7分)
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的 离子方程式:
离子方程式:
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸 钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
| A.MnO2 | B.KMnO4溶液 | C.稀盐酸 | D.Na2SO3溶液 |
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子的物质的量是_________
(4分)在水溶液中,短周期元素Y形成的YO3n-与S2-能发生如下离子反应:
YO3n-+3S2-+6H+Y-+3S↓+3H2O请回答:
(1)此反应中,氧化剂是_____________。(2)YO3n-中n= _______。
(3)Y元素在周期表中位于周期族。
(12分)
(1)乙烯通入溴的四氯化碳溶液中,观察到的现象是 ;其反应方程式为 ;乙烯在一定条件下发生加聚反应的化学方程式为 。
(2)苯分子的结构简式为。苯能发生取代反应,请任写一个苯发生取代反应的化学方程式
(3)把卷成螺旋状的铜丝在酒精灯外焰上加热,使表面变黑,然后迅速伸到无水酒精中,有什么现象,写出总反应的化学方程式,铜丝在反应中起的作用。
在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,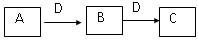
已知A、B、C中均含有同一种元素,D为非金属单质,能使带有火星的木条复燃。
(1)若A在常温下为气体,C是红棕色气体。
①写出A单质的电子式。
②C与水反应所得的溶液呈酸性,此反应中氧化剂与还原剂物质的量之比为
(2)若A为固体单质,C为淡黄色固体,,则C含有的化学键有,
A与水反应的离子方程式为。
(3)若A为日常生活中最常见的烃的衍生物,则A与C反应生成一种有水果香味的物质,其反应的化学方程式为,反应类型为反应。
下列五种物质中,①Ar② ③
③ ④NaOH⑤CaCl2
④NaOH⑤CaCl2
只存在共价键的是(填序号),只存在离子键的是,既存在离子键又
存在共价键的是,不存在化学键的是。属于共价化合物的是,
属于离子化合物的是。
写出下列过程所涉及的主要化学方程式:
①用铝热法炼铁____________________________________________
②电解法冶炼铝____________________________________________
③ NaH溶于水产生H2_______________________________________