写出下列电解质在水溶液中的电离方程式
(1)Ca(HCO3)2:_____________________________;
(2)H2SO3:_____________________________;
写出下列电解质在水溶液中的水解离子方程式
(3)CH3COONa:_____________________________;
(4)Fe2(SO4)3:_____________________________。
某些化学反应可用下式表示 :A + B ─→ C + D + H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,
写出该反应的离子方程式:。
(2)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,则A与B的组合是:。
(3)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物,
(Ⅰ)当C为无色气体时,相应的化学方程式为。
(Ⅱ)当C为红棕色气体时,氧化剂与还原剂的物质的量之 比为,
比为,
每生成标准状况下11.2L的该气体,转移电子的数目约为
(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是。
(5)当C为可以使湿润的红色石蕊试纸变蓝的气体时,实验室进行该气体的尾气处理,应选用下列装置(填序号)
现有一种溶液,其中可能含有Mg2+、Al3+、Fe2+、Cu2+、NH4+。当加入一种淡黄色固体并加热溶解时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。试回答下列问题:
(1)最终的白色沉淀的成分是(填化学式),你的理由是
(2)试确定该溶液中可能含有以上离子中的哪些离子并计算其相应的物质的量,完成下表(可以不填满)
| 可能含有的离子 (填离子符号) |
|||||
| 相应的物质的量 |
(4)图中a点的值为
(5)图中b点的气体组成成分是(填化学式),其物质的量之比是
铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O进行了认真的探究。 Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实 验方案:
验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色
⑴请你评价方案1和方案2。如果你认为方案合理,请简述其化学原理;如果你认为该方
案不合理,请简述原因。
方案1 :
方案2 :
Ⅲ.研究性学习小组乙,设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。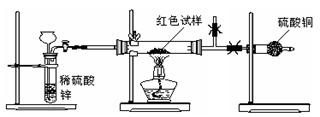
(2)为确保探究的科学、合理、安全,你认为实验中还应采取的措施有:(填序号)
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他均为化合物.试回答下列问题: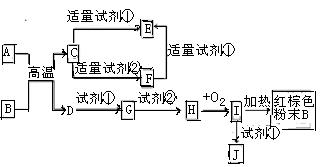
(1)写出物质C的化学式:
(2)写出物质B的一种用途:
(3)以J的饱和溶液制备胶体的操作为 。
。
(4)写出下列反应的方程式:
A→F的离子方程式.
H→I的化学方程式
试剂②可以由一种淡黄色固体粉末和一种常见液体发生反应而制得,其相应的化学方程式
(5)某同学认为J中可能同时含有同一种金属元素的两种阳离子,若要确认其中低价金属阳离子的存在,应选用(选填序号)
A、KSCN溶液和氯水 B、铁粉和KSCN溶液 C、浓氨水 D、酸性高锰酸钾
A、B、C、D、E、F为原子序数依次增大的同 一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E。G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E。G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的电子式
(4)以上元素中原子半径最大的是金属性最强的元素是(均用元素名称回答)
(5)实验室制备G的氢化物的化学方程式:
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1—2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式: