有A、B、C、D四种单质,B、C、D在常温、常压下皆为气体,A是固体。
①B单质可以在C单质中燃烧生成E,其火焰为苍白色;
②化合物E的水溶液可使紫色石蕊试液变红;
③将A在D中燃烧生成一种淡黄色固体F,若将F放水中会生成气体D。
④C能和水反应,所得溶液具有漂白作用。
试推断:
化学式A ; C ; E_________ ; F____________
(3)写出C和水反应的化学方程式
常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示[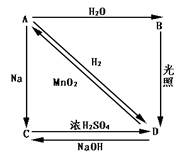
⑴分别写出A、B、C、D的化学式 :
: A; B;
A; B;
C; D。
⑵写出A→B、C→D的化学方程式:
A→B;
C→D。
A元素原子M电子层上有6个电子。B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子。
⑴ B元素的原子结构示意图为___________________;A元素原子的电子式___________;
⑵ A、B两元素形成的化合物的名称是____________,化学式是___________________。
等质量的SO2和SO3分子数之比为,氧元素质量之比为。同质量的氨气和硫化氢气体中所含氢原子个数比是,若两者所含氢原子个数相等,它们的物质的量比是。
在原子结构的探索过程中,很多科学家作出了相应的贡献,我国古代的认为物质是无限可分的,近代原子学说是由提出的,发现了铀的放射性,卢瑟福通过实验,提出了原子结构的行星模型。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3+4H++3e-===NO+2H2O。
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)配平上述总反应方程式并标出电子转移的方向和总数
(2)反应中硝酸体现了________、________性质。
(3)反应中若产生了0.2 mol气体,则转移电子的物质的量是 ________mol。
(4)被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是mol