如图所示的装置测定空气中氧气的含量。将燃烧匙中的红磷点燃
迅速伸入钟罩中并塞上橡胶塞。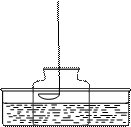
(1) 红磷燃烧的主要现象是
写出反应的文字表达式为
(2)实验结束后拔开胶塞,迅速伸入一燃着的细木条,可能发生的现象是
(3)若实验结果测得氧气的含量不足21%,分析造成这种结果的原因可能有
①
②
一氧化碳是一种重要的化工原料。
(1)高炉炼铁中发生的反应之一是:
 FeO(s)+CO(g) Fe(s)+CO2(g)△H=-1kJ/mol。
FeO(s)+CO(g) Fe(s)+CO2(g)△H=-1kJ/mol。
温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将
(填“增大”、“减小”或“不变”)。
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应.
A.向正反应向向进行 B.处于平衡状态 C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去。在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:W ww.k s5u.co m CO(g)+H2O(g) CO2(g)+H2(g) K=1.0
CO(g)+H2O(g) CO2(g)+H2(g) K=1.0
若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为。
(3)用CO和H2经如下两步反应制得甲酸甲醛:
CO+2H2→CH3OH
CO+CH3OH→HCOOCH2
已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52;CO最多可制得甲酸甲醛多少吨?(写出计算过程)。
班布特罗是一种用于治疗小儿支气管哮喘的药物。它的合成路线如下(ph-表示苯基): 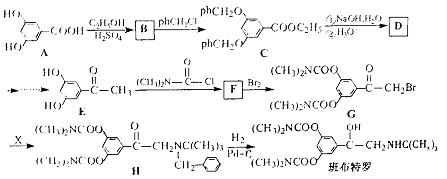
回答下列问题:
(1)A与过量的NaHCO 3溶液反应的化学方程式为 。
(2)F的结构简式为 。
(3)写出满足下列条件的E的一种同分异构体的结构简式 。
①苯的邻二取代物;
②不能与FeCl 4溶液发生显色反应;
③水解产物能发生银镜反应。
(4)由G与X(C 11H 17N)发生取代反应生成H,则X的结构简式为 。
|
|
(5)苯乙酸苯甲酯可用作花香型日用香精。请设计合理
方案以甲苯为原料合成苯乙酸苯甲酯(用合成路
线流程图表示,并注明反应条件), 。 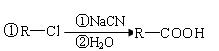
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
|
白云石(主要成分为CaCO4,MgCO2)可用作碱性耐火材料和高炉炼铁的溶制等。
(1)甲同学利用加热法测定白云石中MgCO2的含量,一种将CO2变为燃料或有机化学品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2和CO2在一定条件下转化成CH4和H2O2。
已知:H2(g)+ O2(g)=H2O(l)△H1=—285.8kJ/mol
O2(g)=H2O(l)△H1=—285.8kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=—889.6kJ/mol
H2O(l)=H2O(g)△H3=+44.0kJ/mol
(1)第③步反应的热化学方程式为 。W ww.k s5u.co m
|
(2)若在第②步电解吸收液时产生11.2LO2(标准状况下),则第③步中最多可制得 L甲烷(标准状况下)
(3)为探究在密闭容器中进行第③步反应的最佳投料比,某氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
(1)反应I中加Na2CO3溶液的作用是。
过一步反(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为。
(3)写出反应VI的化学方程式。
(4)反应IV加入的Cu必须过量,其目的是。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是。