已知肼(N2H4)的燃烧热是534 kJ·mol-1,当它氧化生成1g水时,反应放出的热约为
| A.29.7 kJ | B.14.8 kJ | C.-29.7 kJ/mol | D.-14.8kJ/mol |
在密闭容器中发生反应:aA(g) cC(g)+dD(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍。下列叙述正确的是( )
cC(g)+dD(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍。下列叙述正确的是( )
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a<c+d |
下列有关热化学方程式的表示及说法正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+1/2H2SO4 (aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol |
| D.已知I2(g)+ H2(g)=2HI(g) △H1, I2(s)+ H2(g)=2HI(g ) △H2 则△H1>△H2 |
有一处于平衡状态的反应:X(s)+3Y(g) 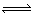 2Z(g),ΔH<0。为了使平衡向生成Z 的方向移动,应选择的条件是()
2Z(g),ΔH<0。为了使平衡向生成Z 的方向移动,应选择的条件是()
①高温 ②低温 ③高压 ④低压⑤加正催化剂⑥分离出Z
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
对于反应2SO2+O2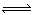 2SO3,下列变化可增大活化分子百分数而使反应速率加快的是( )
2SO3,下列变化可增大活化分子百分数而使反应速率加快的是( )
①增大压强 ②升高温度 ③增大O2浓度 ④使用催化剂
| A.①③ | B.①④ | C.②③ | D.②④ |
一定温度下在容积恒定的密闭容器中,进行反应A(s)+2B(g) 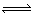 C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体总物质的量 ④B物质的量浓度
| A.①④ | B.只有②③ | C.②③④ | D.只有④ |