已知aRO4x-+bH++cCl-═dR++5Cl2↑+8H2O,则RO4x-中R的化合价为
| A.+4 | B.+5 | C.+6 | D.+7 |
下列反应的离子方程式不正确的是
| A.AgNO3溶液与KC1溶液混合 Ag++Cl-= AgCl↓ |
| B.Na2SO4溶液与BaC12溶液混合 Ba2++SO42-=BaSO4↓ |
| C.Na2CO3溶液与稀HC1溶液混合 CO32-+2H+=CO2↑+H2O |
| D.锌片插入稀H2SO4溶液中 Zn+H+=Zn2++H2↑ |
元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数)。下列说法正确的是( )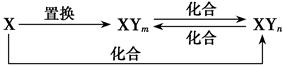
| A.X、Y不可能均为非金属元素 |
| B.若X为Fe,Y只能为Cl |
| C.X一定为金属元素 |
| D.若X为Fe,Y可为Cl、Br、但不能是I |
把足量的铁粉投入到稀盐酸和氯化铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉质量相等,则原溶液中H+和Cl-的物质的量之比为( )
| A.1∶4 | B.1∶7 | C.1∶8 | D.2∶5 |
气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3溶液,若将X通入澄清石灰水中,却不见沉淀产生,则有关气体X的成分的下列说法正确的是( )
| A.一定含有HBr,可能含有CO2、Cl2 | B.一定不含CO2 |
| C.一定不含NH3、Cl2 | D.可能含有Cl2、CO2 |
在中学化学实验中使用的玻璃、陶瓷等仪器,在实验操作中不能承受温度的急剧变化,否则会引起安全事故。下列实验操作过程不是基于上述原因的是( )
| A.钠与水反应时,只能取黄豆粒大小的钠投入盛水的烧杯中反应 |
| B.在用二氧化锰和浓盐酸制氯气时,在加入二氧化锰后应首先加入浓盐酸,然后再点燃酒精灯 |
| C.在用固体氯化铵和氢氧化钙制取氨气结束后,将大试管从铁架台上取下置于石棉网上冷却后再洗涤 |
| D.用排水法收集气体后,先移出导气管,后熄灭酒精灯 |