将气体A、B置于容积为2 L的密闭容器中,发生如下反应:
4A(g)十B(g)=2C(g)
反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol。则用反应物A浓度的减少来表示该反应的速率应为( )
A. 0.025 mol/(L·s) B. 0.012 5 mol/(L·s)
C. 0.05 mol/(L·s) D. 0.1 mol/(L·s)
短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是()
| A.若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B.若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| C.若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| D.若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中,不正确的是 ( )
| A.X的原子核内质子数为 (2a2-1) |
| B.X的原子半径一定小于钠的原子半径 |
| C.由元素X形成的某些化合物,可能具有杀菌消毒的作用 |
| D.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数) |
X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为()
| A. XY | B. XY2 | C.XY3 | D.X2Y3 |
如图为元素周期表截取的短周期的一部分,即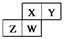 。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是()
。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是()
| A.原子半径:W>Z>Y>X |
| B.气态氢化物的稳定性:Z>W>X>Y |
| C.W的最高正化合价与负化合价的绝对值可能相等 |
| D.Z的最高价氧化物的水化物可能为强碱 |
在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )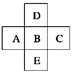
| A.5Z | B.5Z+18 | C.5Z+10 | D.5Z+8 |