用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化气法提纯,其反应式为:
()配平下列反应的化学方程式:
□C+□K2Cr2O7+□H2SO4 CO2↑+□Cr2(SO4)3+□K2SO4+□H2O
(2)反应的氧化剂是 ,氧化产物的电子式 ;
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生0.2molCO2气体,则转移电子的物质的量是 mol。
从樟科植物枝叶提取的精油中含有甲、乙、丙三种成分:
(1)由甲转化为乙的过程(已略去无关产物):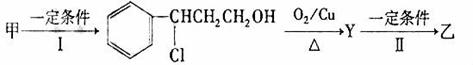
反应Ⅰ和反应Ⅱ的反应类型为和,Y的结构简式 。
。
(2)已知:
由乙制取丙的路线如下(A—E均为有机物,Mr表示相对分子质量):
①由乙转化为D的化学方程式。
②D有多种同分异构体,请任写其中一种能同时满足下列条件的异构体的结构简式 。
。
a.苯环上有三个不同官能团 b.能发生银镜反应
c.能与 发生加成反应 d.遇
发生加成反应 d.遇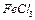 溶液显示特征颜色
溶液显示特征颜色
③E中含氧官能团的名称分别为和,丙的结构简式。
标准状况下,向1 00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
 k+s-5#u
k+s-5#u
已知图中B点位置固定,V(B)="300" ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
| V(A)的取值 |
V(A)=0 |
0<V(A)<150 |
V(A)=150 |
150<V(A)<300 |
| 溶质的成分 |
① |
② |
③ |
④ |
(3)取V(A)="100" mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是。
(现有等物质的量的NaHCO3和KHCO3的混合物a g 与100mL盐酸反应,题中涉及的气体体积均以标准状况计,填空时可以用带字母的分式表示
(1)该混合物中NaHCO3和KHCO3的质量比是___________________________
(2)如碳酸氢盐和盐酸恰好完全反应,则盐酸的物质的量浓度为____________________
(3)如盐酸过量,生成CO2体积为______________________________________________
(4)如果反应后碳酸氢盐有剩 余,
余, 盐酸不足量,要计算生成CO2的体积,还需要知道_______________________
盐酸不足量,要计算生成CO2的体积,还需要知道_______________________ ______________________________________________
______________________________________________
(5)若NaHCO3和KHCO3不是以等物质的量的混合,则a g 混合物与足量的盐酸完全反应时生成CO2的体积范围是____________________________________________
从某些植物树叶提取的挥发油中含有下列主要成分: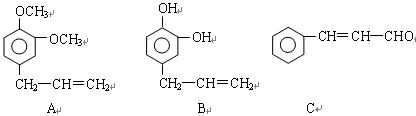
(1)有关A、B、C三种物质的说法正确的是(填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为。
(3)0.5molB与足量的溴水充分反应,消耗mol单质溴。
(4)已知: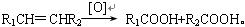 有机物C9H8O发生如下反应:
有机物C9H8O发生如下反应: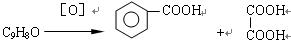
则C9H8O的结构简式为。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
在新型锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用G表示)的结构简式如下:
G的合成方法如下:
请回答下列问题:
(1)反应①、⑤的反应类型分别为_______,________。
(2)A的结构简式___________。
(3)写出含有-OH和-COOH的D的同分异构体任意2种:
_________________________,_______________________________。
(4)写出B→C反应方程式________________________________________。
(5)写出E→F反应方程式________________________________________。