现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复):H+、Na+、A13+、Ag+、Ba2+、 OH—、C1—、CO32—、NO3—、SO42—
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
④在E溶液中逐滴加入B溶液,溶液先出现沉淀,当滴加至过量时,沉淀部分溶解。
试回答下列问题:
(1)A、C的化学式分别为 、 。
(2)A溶液呈碱性的原因 (用离子方程式表示)。
(3)在100mL0.1mol·L-1的E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀的物质的量为 。
下图表示常见元素单质及化合物相应关系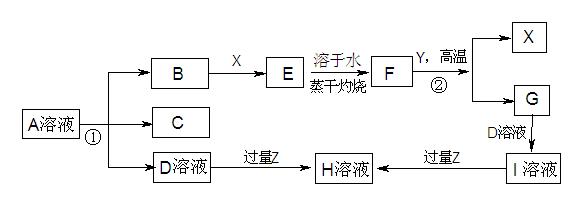
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分
请回答下列问题:
(1)D的电子式;H为(填化学式)
(2)完成下列方程式
空气中含量最高的气体与C反应的化学反应方程式
反应②的化学 反应方程式
反应方程式
足量B通入H溶液的离子反应方程式
(1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________。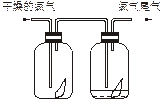
 (2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
(2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(均填化学式),
长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)当氯气泄漏人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液 的毛巾捂住鼻子,最适宜采用的该物质是_______。
的毛巾捂住鼻子,最适宜采用的该物质是_______。
A.NaOH B.NaCl C.KBr D.Na2CO3
(4)氯气和二氧化硫都有毒,但将两者等物质的量混合通入水中毒性会消失,用离子方程式表示毒性消失的原因
有关元素X、Y、Z、D、E的信息如下
| 元素 |
有关信息 |
| X |
元素主要化合价为—2,原子半径为0.074nm |
| Y |
所在主族序数与所在周期序数之差为4 |
| Z |
原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色。 |
| D |
最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E |
单质是生活中常见 金属,其制品在潮湿空气中易被腐蚀或损坏 金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)。
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY 2只能通过置换反应生成,EY3只能通过化合反应生成
2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程:,D2Z水溶液显性
用离子方程式表示其原因
(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感。YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得。请写出反应的离子方程式:。
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中
有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。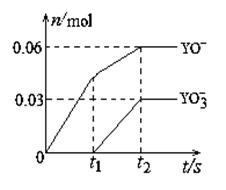
该苛性钾溶液中KOH的质量是g,该反应中转移电子的物质的量是mol。
在一定条件下,某些化学反应可以下图框架表示,根据要求回答下列问题: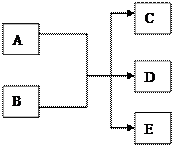
(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,D具有漂白性,写出该反应的离子方程式;
(2)若通过电解的方法获得黄绿色气体C,则该反应的离子方程式为
(3)若C、D均为气体且均能使澄清石灰水变浑浊,写出符合上述框图要求的化学方程式
(4)若C是一种极易溶于水的气体,D是一种常见的干燥剂,写出A和B反应的化学方程式
(5)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物,写出符合上述框图关系的离子方程式 (写出符合要求的一个即可)。
(6)若C是食盐溶液,D是一种白色胶状沉淀,E是一种能产生温室效应的气体,写出符合上述框图关系的离子方程式 (写出符合要求的一个即可)。
(共17分).Ⅰ、一无色透明的溶液做如下实验:
ⅰ取少量溶液滴加盐酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
ⅱ另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示:
试问:
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、CO32-、K+、SO42-等离子中一定存在的离子是____、____、______;可能存在的离子是_______、_____;一定不存在的是______、____、_____、____。
(2)上述溶液至少由__________、_________等物质混合成。(填化学式)
Ⅱ、甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
| 物质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1molH2O(g)转变为1molH2O(l)时放出44.0 kJ热量。
⑴写出CO燃烧的热化学方程式 。
。
⑵ 2H2(g) + O2(g)="=" 2H2O(g) △H=kJ/mol