将18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100 mL,实验操作如下,请并填写有关空格:
①用 取 mL的18.0 mol·L-1的浓硫酸;
②将浓硫酸沿烧杯内壁慢慢注入盛有少量 的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入 ;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
⑥改用胶头滴管逐滴加蒸馏水,至 ;
⑦盖好容量瓶塞,反复颠倒摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。#网
请回答:
⑴若量取浓硫酸时没有洗涤量取浓硫酸的量器,浓度将 (填写“偏大”、“偏小”或“不变”)
⑵定容时,俯视刻度线,浓度将 (填写“偏大”、“偏小”或“不变”)
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
H++MnO4-+H2C2O4→CO2↑+Mn2++
(1)配平以上离子方程式,并在□中填上所需的微粒。(2)该反应中的还原剂是。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为mol。
【化学—有机化学基础】(13分)
奶油中含有有一种可作香料的化合物A,A中只含C、H、O三种元素。通过红外光谱图分析可知A中含有碳氧双键;通过李比希法分析得到A分子中C、H、O原子个数比为2:4:1,通过质谱仪分析其相对分子质量为88。
已知: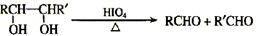
与A相关的反应如下: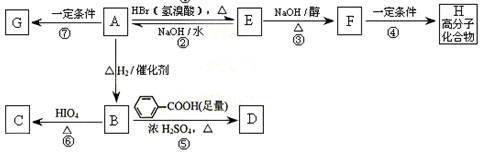
(1)A的分子式为,H的结构简式为。
(2)上述7步反应中属于取代反应的是(填序号)。
(3)写出B → D反应的化学方程式:。
(4)B的核磁共振氢谱图中共有个峰。
(5)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G。G有多种同分异构体,其中符合下列两个条件的同分异构体共有种。
A.无环状结构B.不含碳碳双键和碳碳叁键
【化学——物质结构与性质】13分)
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。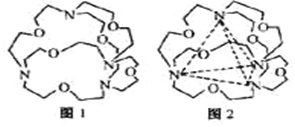
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g)ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g)ΔH2、
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,则在电化学合成氨的过程中,阴极反应式为;
2NH3,则在电化学合成氨的过程中,阴极反应式为;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①A点时N2的浓度为mol/L;
②右图中在状态A时,平衡常数 KA =(填写代入数值的表达式,不要求化简);当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min 浓度/mol•L—1 |
c (N2) |
c (H2) |
c (NH3) |
| 0 |
0.6 |
1.8 |
0 |
| 3 |
0.52 |
x |
0.16 |
| 6 |
0.36 |
1.08 |
0.48 |
| 9 |
0.36 |
1.08 |
0.48 |
反应从0 min到3 min之间,H2的反应速率为;反应在3 min时,条件发生了改变,改变的条件可能是(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.充入Ne增大压强
A、B、C、D、E 五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3∶4,E原子的电子层数等于最外层电子数,D的原子序数小于E。请用化学用语回答相关问题:
(1)A元素在周期表中的位置。
(2)比较C和E简单离子半径大小:。
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):;
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体。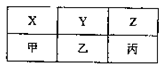
①甲的分子式为;丙的电子式为。
②乙的分子式为B2D4,乙和丙常作火箭推进器的燃料,反应后的产物无污染。已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式:。