(1)在Cu +2H2SO4(浓) CuSO4 +SO2↑+2H2O反应中,请用双线桥法标出电子得失情况,并指出氧化剂、还原剂,氧化产物、还原产物。
CuSO4 +SO2↑+2H2O反应中,请用双线桥法标出电子得失情况,并指出氧化剂、还原剂,氧化产物、还原产物。
氧化剂 ;还原剂 氧化产物 ;还原产物
(2)在 2H2S +O2=2S+2H2O 反应中,请用单线桥法标出电子转移情况,并指出被氧化的元素是 ;被还原的元素是 。(写元素符号)
A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应。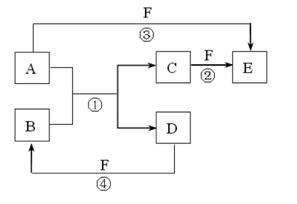
请回答下列问题:
(1)若B是黄绿色气体,C、F是空气的主要成分,A、D相遇有白烟生成,则该白烟的化学式为,反应③的化学方程式为。
(2)若A、D、F都是非金属单质,A、D所含元素同主族,A、F所含元素同周期,则B所属晶体类型是,其一个重要的用途是。
(3)若A是常见的金属单质,D、F是气态单质,反应①②在水溶液中进行,则反应②的离子方程式为。工业上冶炼金属A的反应原理是(用化学方程式表示)。
(4)若A、D是常见单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,反应③④中都有红棕色气体生成。则反应①的化学方程式为
。
在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应 ,n(NO)随时间的变化如下表:
,n(NO)随时间的变化如下表:
| 时间/s |
0 |
10 |
20 |
30 |
40 |
50 |
| n(NO)/mol |
0.2 |
0.1 |
0.08 |
0.07 |
0.07 |
0.07 |
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为;达到平衡时NO的转化率为。
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是热反应(填:“吸”、“放”)
(3)下列能说明该反应已达到平衡的是。
A.容器内压强不变 B.容器内气体密度不变
C.n(NO)= n(NO2) D.容器内气体颜色不变
E.容器内混合气体的平均分子量不变 F.v(NO2) =2v(O2)
(4)若改变某一条件,达新平衡时n(NO)=" 0.06" mol,下列说法正确的是。
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.NO的转化率一定增大
D.可能是缩小了容器的体积
(5)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式。
X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
①它们核外电子总数都相同;②N溶于M中,滴入酚酞,溶液变红;
③X和N都由A、C两元素组成,X和Y核内质子数相等;
④Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
⑤Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的。
根据以上信息,请回答下列问题:
(1)Y的化学式为,X的电子式为。
(2)试比较M和N的稳定性:MN(填“>”、“<”、“=”)
(3)检验X的方法是。
(4)由A、B、C三种元素组成的物质中,属于离子化合物的有,属于共价化合物的有(各任写一种物质的化学式)
(5)上述六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入0.1mol/L氢氧化钠溶液,随着氢氧化钠溶液的加入,产生沉淀的关系如下图,则该复盐的化学式为。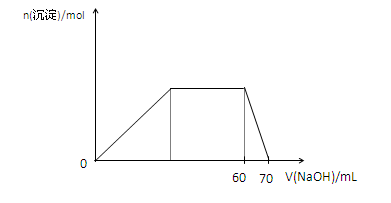
某元素M所形成的气态单质为双原子分子,共有三种形式,其式量分别为70、72、74,它们的物质的量之比为9∶6∶1,则:
(1) M有______种同位素,其质量数分别为_________________;
(2)各种同位素所占的原子百分比分别为多少?
(3)M2的平均式量为多少?
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。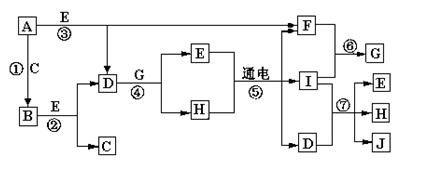
回答下列问题:
(1)B的化学式:,E的电子式_________。
(2)写出反应⑦的离子方程式 __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴、阳”)极附近溶液由无色变为红色,其原因是_________________ 。