绿色化学是当今社会人们提出的新概念,它可以公开为环境友好化学。安的着眼点是使污染消灭在生产的源头,从根本上消除污染。请回答下列问题:
(1)、下列叙述错误的是:
A、绿色化学和环境化学都是研究保护环境的;
B、绿色化学不是被动的治理环境,而是主动地防治环境污染;
C、绿色化学保护了环境,而且也能给企业带来经济利益。
(2)、硝酸工业的尾气中主要含有NO、NO2气体。下列关于它的危害的叙述中,正确的是: 。
A、形成酸雨;
B、破坏臭氧层;
C、NO能刺激呼吸道;
D、NO2能跟血红蛋白作用生成二氧化氮血红蛋白而引起中毒;
E、NO、NO2在空气中能形成褐色或红色的毒性好大的烟雾。
(3) 工厂里常采用NaOH溶液吸收NO、NO2,使其转化为化工产品NaNO3。请写出有关的化学方程式: ,这一处理方法是否符合绿色化学概念: (填“是”或“不是”);其原子利用率为: 。
I、(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA + HB- (少量)=A_ + H2B ,②H2B(少量) + C- = HB_ + HC ,③HA(少量) + C- =A_ + HC 。则三种酸对应的电离平衡常数分别为(请填空)
| HA |
H2B |
HC |
||
| Ka |
Ka1 |
Ka2 |
Ka3 |
Ka4 |
| 数值 |
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小是:_______
A c(H+) B c(H+)/c(CH3COOH) C c(H+)·c(OH-)
Dc(OH-)/(H+)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数_____(填大于、等于或小于)醋酸平衡常数;理由是___________________________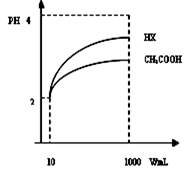
II、工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。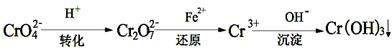
(1)转化过程中存在平衡2CrO42- + 2H+ Cr2O72- + H2O能说明反应到达平衡状态的是
Cr2O72- + H2O能说明反应到达平衡状态的是
A.CrO42-和Cr2O72-的浓度相同 B.2ν(Cr2O72-)=ν(CrO42-)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1L转化后所得溶液中含铬元素质量为28.6g,CrO42-有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。①转化后所得溶液中c(Cr2O72-)=
②已知:常温下该反应的平衡常数K=1014,上述转化后所得溶液的pH为
(3)还原过程中的离子反应方程式
(4)若常温下Ksp(Cr(OH)3)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol ,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
二、下表为B与F实验的部分内容
①在含B的溶液中加入稀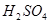 ,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 ,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀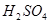 反应的离子方程式
反应的离子方程式
写出②中反应的化学方程式
(3)现由6种粒子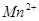 、
、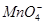 、
、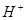 、
、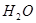 、
、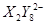 (C中含有的阴离子),
(C中含有的阴离子),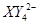 完成一个离子方程式,已知
完成一个离子方程式,已知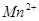 为还原剂,得到1mol
为还原剂,得到1mol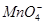 需氧化剂的物质的量为mol
需氧化剂的物质的量为mol
(4)化合物D和E相互转化D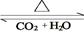 E,若有D和E ·
E,若有D和E ·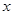 H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E ·
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E ·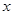
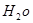 的化学式为
的化学式为
(9分)下表是元素周期表的一部分,根据表中10种元素填空。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
|||
| 4 |
⑧ |
⑨ |
⑩ |
(1)①~⑩元素中,金属性最强的是(填元素名称);
(2)⑤元素对应的最高价氧化物水化物的浓溶液和 ①单质加热反应的化学方程式为;
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是,碱性最强的
是,呈两性的是;(填化学式)
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是。
(用离子符号表示)
4分)下列各组物质(填序号) ① O2和O3② H2、D2、T2 ③ 12C和14C
④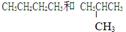
(1)互为同分异构体的是______, (2)互为同位素的是____,
(3)互为同素异形体的是_______, (4)是同一物质的是____。
X、Y、Z、W四种元素在元素周期表中序数逐渐增大。X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)Z的元素原子结构示意图是:,位于周期表中第_____周期第 族;
(2)有X、Y、Z所形成的离子化合物是 ,它与W的最高价氧化物对应水化物的溶液加热时反应的离子方程式是;
(3)Y的单质的电子式为,结构式为,其中的化学键属于键(填“离子”或“共价”)。