某地甲、乙两工厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag +、Ba 2+、Fe 2+、Na +、Cl -、SO 4 2-、NO 3 -、OH -。若两厂单独排放污水都会造成较严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是( )
| A. | Na +和NO 3 -来自同一工厂 | B. | Cl -和NO 3 -一定来自同一工厂 |
| C. | Ag +和Na +可能来自同一工厂 | D. | SO 4 2-和OH -一定来自同一工厂 |
下列说法正确的是
| A.Na2O2可作为潜艇工作人员的供氧剂 |
| B.常温下铝箔放在浓HNO3中,生成H2 |
| C.水蒸气通过炽热的铁,生成Fe(OH)3和H2 |
| D.用新制Cu(OH)2检查尿糖,Cu(OH)2是还原剂 |
下列实验正确的是
| A.用量筒量取15.50mL 0.100 mol·L-1盐酸 |
| B.用无水酒精萃取碘水中的碘 |
| C.用过量浓氨水洗涤试管内的银镜 |
| D.做H2还原CuO实验时,要先通氢气,验纯后再加热 |
下列说法正确的是
| A.甲烷、乙烯、苯等原料主要来自于石油的分馏 |
| B.料酒和食醋都能以淀粉为原料制得 |
| C.聚酯纤维、有机玻璃、光导纤维都属于有机高分子材料 |
| D.PM 2.5(微粒直径约为2.5×103nm)分散在空气中形成胶体(或气溶胶) |
把0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,溶液显酸性,下列叙述正确的是
| A.c(CH3COO-)>c(Na+) |
| B.c(CH3COOH)> c(CH3COO-) |
| C.c(CH3COOH)+ c(CH3COO-)=0.1mol•L-1 |
| D.加入少量NaOH固体,c(Na+)增大而c(CH3COO-)减小 |
在一定条件下,固定容积的密闭容器中反应:2NO2(g) 2NO (g) +O2 (g)△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
2NO (g) +O2 (g)△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是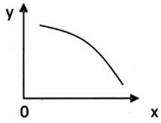
| A.当X表示温度时,Y表示NO2的物质的量 |
| B.当X表示压强时,Y表示NO2的转化率 |
| C.当X表示反应时间时,Y表示混合气体的密度 |
| D.当X表示NO2的物质的量时,Y表示O2的物质的量 |