【物质结构与性质】
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)CH3+、·CH3、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们的空间构型相同,碳原子均可以采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp3杂化,所有原子均共面 |
(2)在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电 量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
①HCl、CS2、H2S、SO2四种分子中μ=0的是 ;
②实验测得:μPF3 =1.03、μBCl3=0。由此可知,PF3分子是 构型,BCl3分子是 构型。
=1.03、μBCl3=0。由此可知,PF3分子是 构型,BCl3分子是 构型。
(3) 对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
(4)利用光电子能谱证实 :在洁净铁(可用于合成氨
:在洁净铁(可用于合成氨
反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在单层晶面上N/Fe原子数之比为________________。
(5)金属晶体的结构可用等径圆球的密堆积来描述,在等径圆球的最密堆积的各种形式中,立方最密堆积和六方最密堆积最为重要,请指出下图中哪个为立方最密堆积 (填“A”或“B”)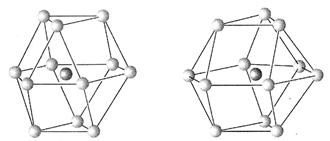
图A 图B
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是_________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③________________________。
(3)测定样品中Cl-含量的方法是:A. 称取0.750 0 g样品,溶解,在250 mL容量瓶中定容;B. 量取25.00 mL待测溶液于锥形瓶中;C. 用0.050 00 mol· L-1 AgNO3
溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需要溶液润洗的仪器有_______________________________。
②计算上述样品中CaCl2·2H2O的质量分数为________________。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因是___________________;____________________。
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l) = 2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中氧化剂是_____________________________。
(2)火箭残骸中常出现红棕色气体,原因为N2O4(g) 2NO2(g)(Ⅱ),当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
2NO2(g)(Ⅱ),当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是____________。
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是_____________________(用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将_____________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___________mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1)
膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
(1)A装置是__________,B装置是_____________(填“原电池”或“电解池”)。
(2)N2O5在电解池的__________(填“c极”或“d极”)区生成,其电极反应式为_________________。
(3)A装置中通入O2一极的电极反应式为_________________。
(4)若A装置中通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为____________mL·min-1。
在T ℃条件下,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g)ΔH=- Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
aZ(g)+W(g)ΔH=- Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为____________。
(2)写出该反应的平衡常数表达式K=____________(a必须用具体的值表示)。
(3)下列说法中能说明该反应达到化学平衡状态的是______________________。
A. 容器内压强一定
B. 容器内气体的密度一定
C. 容器内Z分子数一定
D. 容器内气体的质量一定
(4)X的转化率α=________,Y的平衡浓度为__________mol·L-1(均用含Q、Q1的代数式表示);
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_________(稀有气体不参与反应)。
A. 2 mol X,1 mol Y,1 mol Ar
B. a mol Z,1 mol W
C. 1 mol X,0.5 mol Y,0.5 mol Z,0.5 mol W
D. 2 mol X,1 mol Y,1 mol Z
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液_______(填“显酸性”“显碱性”“显中性”或“酸碱性无法确定”),原因是________________________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是__________(填字母)。
A. c(H+)·c(OH-)=1×10-14 mol2·L-2
B. c(Na+)+c(K+)=c(HA-)+2c(A2-)
C. c(Na+)>c(K+)
D. c(Na+)+c(K+)="0.05" mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)ΔH>0。
Ca2+(aq)+A2-(aq)ΔH>0。
①温度升高时,Ksp_________(填“增大”“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)_________,原因是_________________ (用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:_________________________________。