(8分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
| 实验用品 |
溶液温度 |
中和热 |
|
||
| T1 |
t2 |
ΔH |
|||
| ① |
50 mL0.55 mol·L-1 NaOH溶液 |
50 mL0.5 mol·L-1 HCl溶液 |
20 ℃ |
23.3 ℃ |
|
| ② |
50 mL0.55 mol·L-1 NaOH溶液 |
50 mL0.5 mol·L-1 HCl溶液 |
20 ℃ |
23.5 ℃ |
(已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。)
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:
| 化合物 |
燃烧热 |
化合物 |
燃烧热 |
| 甲烷 |
891.0 |
正丁烷 |
2 878.0 |
| 乙烷 |
1560.8 |
异丁烷 |
2 869.6 |
| 丙烷 |
2 221.5 |
2-甲基丁烷 |
3 531.3 |
(1)已知:物质的能量越高越不稳定,根据表中的数据,比较正丁烷、异丁烷的热稳定性:正丁烷______异丁烷(填“>”、“=”或“<”)。
(2)写出乙烷燃烧的热化学方程式:________________________
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量______(填“越多”、“越少”或“相同”)。
(15分)甲醇(CH3OH)是用来制备汽油添加剂和许多普通塑料的原料,低温液相合成甲醇的方法如下。
反应原理:2H2+ CO→CH3OH;反应条件:以三乙二醇二甲醚作为溶剂,以Raney-Ni和CH3ONa为催化剂。
(1)氢碳比[γ =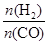 ]:当γ=2时,甲醇的选择性[λ =
]:当γ=2时,甲醇的选择性[λ =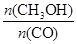 ]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式。
]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式。
(2)干燥除水:为防止CH3ONa的水解,必须干燥除水,下表是不同干燥方法时对CO转化率的影响。
| 序号 |
干燥方法 |
CO转化率/% |
| ① |
不处理 |
40.2 |
| ② |
无水乙醇洗 |
56.3 |
| ③ |
以四氢呋喃洗 |
62.4 |
| ④ |
无水乙醇洗并真空干燥 |
70.1 |
| ⑤ |
77.2 |
从实验设计完整性思考,请补充实验⑤中的干燥方法。
(3)反应温度:下图是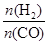 = 2时甲醇合成过程中压力和温度随时间变化的图像。
= 2时甲醇合成过程中压力和温度随时间变化的图像。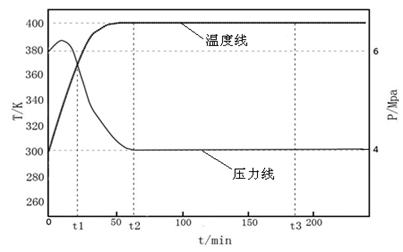
在反应CO(g)+2H2(g)→CH3OH(g)△H中,△H0(填“>”或“<”);0~t2时间段内,随反应的进行体系的压力先增大后减小,原因是;能判断该反应基本结束的时刻为;若t3时刻,测得平衡后CO的转化率为75%,若起始反应时的CO的物质的量为a mol,假设反应容器的体积为1L,则t3时的平衡常数的值为。
(4)催化剂:在保持其它条件不变,只改变催化剂的用量,分别在1L恒容密闭容器中反应,测定10min时的CO转化率。下图是Raney-Ni为0.05g时,CO转化率与时间关系图,请画出Raney-Ni为1g时,CO转化率与时间变化图。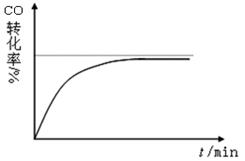
(14分)甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成。常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物。试回答下列问题:
(1)甲的结构式。
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为(写化学式)。16g甲在空气中充分燃烧,生成一种常见液态物质和氮气,放出311kJ热量,则其热化学方程式为。
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式。
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液。
①写出其离子方程式。
②若所得溶液中阳离子浓度均约为0.1mol/L,再向所得混合溶液中加丙,最先得到沉淀(不同浓度的阳离子开始和完全以氢氧化物沉淀的pH如下图)。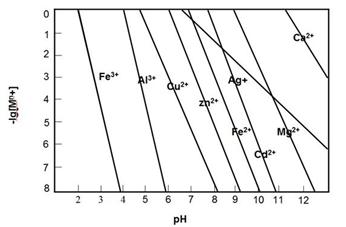
③向上述混合液中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
[化学—选修5:有机化学基础](15分)
(15)蓓萨罗丁(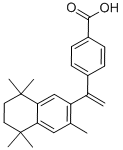 )是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):
)是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):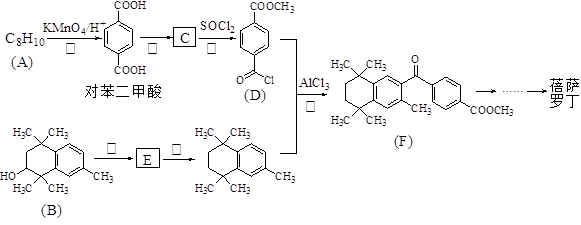
已知:Ⅰ.  Ⅱ.
Ⅱ.
试回答下列问题:②③⑥
(1)蓓萨罗丁的分子式是; F分子中官能团的名称为、。
(2)原料A的核磁共振氢谱的峰面积之比为;原料B发生反应④所需的条件为。
(3)反应①~⑥中属于的取代反应类型的有(填序号)。
(4)E物质具有的性质是__________________。
a. 属于芳香烃
b.与Br2在不同条件下既能发生加成反应,也能发生取代反应
c.与酸性高锰酸钾反应,化学键只一处断裂
(5)反应②的化学方程式分别为__________________________。
(6)对苯二甲酸有多种同分异构体,写出符合下列条件的同分异构体的结构简式。
①苯环上有三个取代基,且均匀分布;②能与浓溴水发生沉淀反应;③能发生银镜反应。
【物质结构与性质】
碳元素可以组成不同的单质和化合物。
(1)碳原子的电子排布图为_______________
(2)由C和同周期的元素组成的分子如图a,推测分子式是____________,键角为_______。 图a
图a
(3)CO2分子的结构式为__________,与它等电子体的分子有___________;
(4)第ⅡA金属碳酸盐分解温度如下:
| BeCO3 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
|
| 分解温度 |
100℃ |
540℃ |
960℃ |
1289℃ |
1360℃ |
碳酸盐中CO碳原子是________杂化,其空间构型为________________。
解释上列碳酸盐分解温度越来越高的原因是_________________________。
(5)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图2 晶胞结构,化学式为____________________。Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
在晶胞中,给出的平行六面体的棱长单位为nm,相对原子质量Li:7、C:12。
则锂电池负极材料的密度为_____________g·cm-3(用含a、b代数式表示)。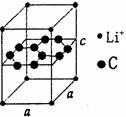
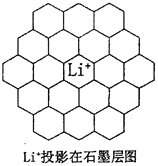
图2图3