无色的混合气体甲,可能含有 NO、CO2、NO2 、NH3 、N2中的某几种。将100 mL甲气体经过如图实验装置的处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为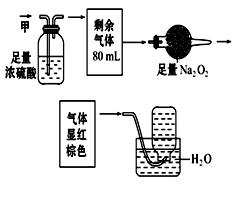
| A.NH3、NO2、N2 |
| B.NH3、NO2、CO2 |
| C.NH3、NO、CO2 |
| D.NO、CO2、N2 |
由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
| A.②④⑤③① | B.③②④①⑤ |
| C.③④②⑤① | D.②④③⑤① |
在氧气中灼烧0.8g由硫、铁元素组成的化合物,使其中的硫经过一系列变化最终全部转化为硫酸,用20 mL 1 mol·L-1的烧碱溶液恰好能完全中和这些硫酸,则原混合物中硫的质量分数约为()。
| A.40% | B.46% | C.53.3% | D.80 % |
接触法制硫酸和工业制硝酸分别经过以下的变化:
下列说法正确的是()。
| A.所有变化都是氧化-还原反应 | B.②③⑤⑥都是化合反应 |
| C.②④反应都要用催化剂 | D.②⑥反应需要足量的氧气 |
在接触法制硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是()
| A.硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧 |
| B.SO2氧化为SO3时需要高压,这样可以提高SO2的转化率 |
| C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率 |
| D.用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收 |
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(如图),图中在a、b、c处流入或流出的气体正确的是()
| A.a处SO2、N2 | B.b处SO2、O2、N2 |
| C.a处SO3、O2 | D.c处SO3、N2 |