根据反应(1)Br2 +2Fe2+=2Br-+2Fe3+ ; (2)2Fe3+ + 2I-= 2Fe2+ + 2I2 ,可判断离子的还原性由强到弱的顺序正确的是 ( )
| A. Br- > Fe2+ >I- | B.Fe2+>I-> Br-_ |
| C.Br->I-> Fe2+ | D.I-> Fe2+ > Br- |
分类法在化学学科发展中起到了非常重要的作用,下列分类标准合理的是
| A.根据是否含有氧元素,将物质分为氧化剂和还原剂 |
| B.根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 |
| C.根据水溶液是否能够导电,将物质分为电解质和非电解质 |
| D.根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是
| A.Cl2+2KBr==2Br2+2FeCl3 |
| B.2Na2O2+2CO2=2Na2CO3+O2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2NaHCO3=Na2CO3+H2O+CO2↑ |
下列各组物质中,不能满足下图物质一步转化关系的选项是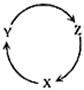
| X |
Y |
Z |
|
| A |
SO2 |
H2SO3 |
H2SO4 |
| B |
CO2 |
Na2CO3 |
NaHCO3 |
| C |
Fe |
FeCl3 |
FeCl2 |
| D |
Cu |
CuSO4 |
Cu(OH)2 |
下列物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的是
① NaHCO3②Na2CO3 ③NH4HCO3 ④SO2 ⑤ (NH4)2CO3
| A.①②③ | B.②③④ | C.①③⑤ | D.全部 |
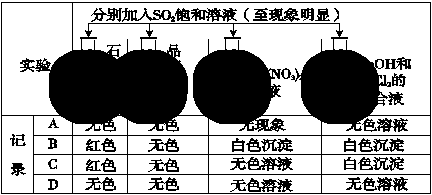
实验报告记录的实验现象正确的是