有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
① 将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
② 向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③ 取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④ 另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是 ,一定不含有的物质是 ,可能含有的物质是 。(写化学式)
(2)写出各步变化的离子方程式。
① ;
② ;
③ ;
④
。
实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2 ,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2 ,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷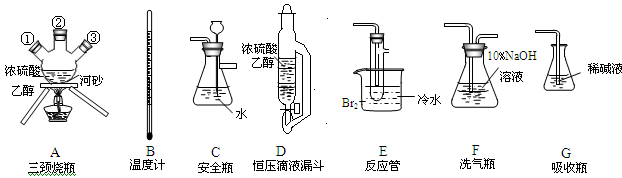
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接接接接接。
(2)温度计水银球的正确位置是。
(3)装置D与分流漏斗相比,其主要优点是。
(4)装置C的主要作用是,装置F的作用是。
(5)在反应管E中进行的主要反应的化学方程式为。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是。若将装置F拆除,在E中的主要反应为。
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为y g,滴定管的读数为amL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞 ,通过分液漏斗加入过量 (填化学式),与烧瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为z g。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积______(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为 。(该实验条件下的气体摩尔体积为Vm)。
银氨溶液可用于检测CO气体,实验室研究的装置如图:
 |
已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的(填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是。
②根据上述实验现象判断,上层清液中产物成分为(填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净,,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为g。
(11分)黄铁矿石的主要成分为FeS2(含少量FeS,假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体。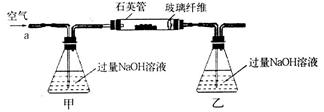
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理: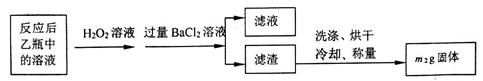
(1)甲装置的作用是___________________;鼓入空气的作用是______________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是_________________(用化学方程式表示)。
(3)该黄铁矿石中硫元素的质量分数为_______________________(列出表达式即可)。
【实验二】测定铁元素的含量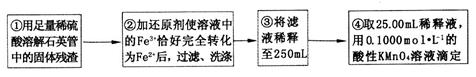
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量______________ (填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=________________。
(10分)化学是一门以实验为基础的学科,试回答以下问题。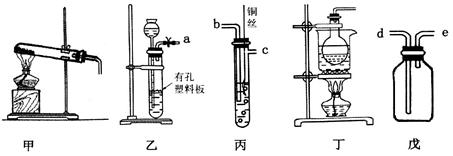
(1)实验室中制取并收集少量氨气,可选用上述____________(填装置序号)装置,氨气应从收集装置的____________(填字母序号)导管进气。
(2)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中盛满稀NaOH溶液,正确的连接顺序为___________________(用接口字母表示),装置乙的作用是____________,丙中产生NO的离子方程式为____________________________。
(3)二氧化氯(C1O2)是一种常用高效消毒剂,某研究小组利用丁装置制备C1O2。
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热。反应生成ClO2、CO2和K2SO4,则该反应中氧化产物与还原产物物质的量之比为_________;
②温度过高时,二氧化氯的水溶液有可能发生爆炸。在反应开始前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60℃~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是_____________;
③将二氧化氯溶液加入到硫化氢溶液中,然后加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式________________。