一定条件下,可逆反应:X(g) + 3Y(g)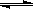 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol•L-1、0.3 mol•L-1、0.08 mol•L-1.则下列判断不正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol•L-1、0.3 mol•L-1、0.08 mol•L-1.则下列判断不正确的是
| A.c1∶c2="=" 1∶3 |
| B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 |
| D.c1的取值范围为0< c1< 0.14 mol•L-1 |
下列事实能说明HNO2是弱电解质的是()
| A.NaNO2溶液的pH大于7 | B.用HNO2溶液做导电实验灯泡很暗 |
| C.HNO2溶液不与硫酸钠反应 | D.HNO2易分解产生NO、NO2 |
下列物质的溶液加热蒸干、灼烧后,所得的固体成份不相同的是()
| A.FeCl2、FeCl3 | B.NaHCO3、Na2CO3 |
| C.NaAl(OH)4、AlCl3 | D.Mg(HCO3)2、MgCl2 |
下列溶液中一定显碱性的是()
| A.溶液中:[OH─]>[H+] | B.溶液的pH>7 |
| C.滴加甲基橙后溶液显黄色 | D.滴加甲基橙后溶液显红色 |
下列离子方程式中,属于水解反应的是()
A.HCOOH+H2O HCOO- + H3O+ HCOO- + H3O+ |
B.CO2+H2O HCO3- + H+ HCO3- + H+ |
C.CO32- + H2O HCO3- + OH- HCO3- + OH- |
D.HS- + H2O S2- + H3O+ S2- + H3O+ |
一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的:①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CH3COONa固体;⑥NH4Cl固体;⑦CuSO4固体⑧CaCO3固体()
| A.①②⑤⑦ | B.②③⑥ | C.②③④⑤ | D.②④⑤ |