20、25℃时,向V mL PH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl—的物质的量恰好等于Na+的物质的量,则a+b的值是
| A.15 | B.14 | C.13 | D.不能确定 |
下列物质属于强电解质的是
| A.CH3COOH | B.Cl2 | C.NH4Cl | D.SO2 |
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生。下列能源符合未来新能源标准的是
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO42-、NO2-、CO32-,现取三份20mL该溶液进行如下实验:
⑴第一份加入足量盐酸,无任何气体产生
⑵第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
⑶第三份滴加0.10 mol∙L-l酸性KMnO4溶液,恰好完全反应,消耗其体积为VmL
⑷另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是
| A.原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- |
| B.由实验⑴可推断原混合溶液中是否含有SO42- |
| C.由实验⑵、⑶可判定原混合溶液中是否含有Fe3+ |
| D.由实验⑶可判定原混合溶液中存在NO2- |
下列说法正确的是
| A.在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 |
| B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-) ,且c(Mg2+)∙c(CO32-)=6.82×10-6 |
| C.对于反应2N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ∙mol-1,它只在高温下自发进行 |
| D.常温下,将0.2 mol∙L-1某一元碱(ROH)溶液和0.1 mol∙L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为: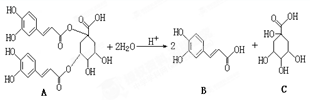
下列说法不正确的是
| A.A在一定条件下能发生取代反应、加成反应和消去反应 |
| B.1mol A和足量NaOH溶液反应,最多消耗11molNaOH |
| C.B能和浓溴水发生反应,1mol B最多消耗4 molBr2 |
| D.C分子中含有手性碳原子 |