下列实验操作均要用到玻璃棒,其中玻璃棒的作用及其目的相同的是( ) 
 ① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶中转移液体
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶中转移液体
| A.①和④ | B.①和③ | C.①和② | D.③和④ |
下列说法中正确的是( )
| A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| B.Ksp越小,难溶电解质在水中的溶解能力一定越弱 |
| C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 |
| D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同 |
下列有关沉淀溶解平衡的说法中,正确的是( )
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
室温下,0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-)。则下列关系中一定正确的是( )
| A.c(Na+)+c(H+)=c(HB-)+2c(B2-) | B.c(H+)·c(OH-)=10-14 |
| C.c(Na+)=c(B2-)+c(HB-) | D.溶液的pH=1 |
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC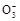 )+c(H+)>c(C )+c(H+)>c(C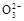 ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S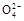 )>c(N )>c(N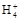 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC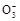 )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
下列叙述正确的是( )
A.浓度均为0.1 mol·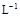 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)="0.2" mol· 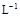 |
B.0.1 mol·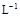 NaHCO3溶液中:c(Na+)=c(HC NaHCO3溶液中:c(Na+)=c(HC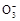 )+c(H2CO3)+2c(C )+c(H2CO3)+2c(C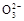 ) ) |
C.0.2 mol·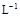 HCl溶液与等体积的0.1 mol· HCl溶液与等体积的0.1 mol·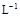 NaOH溶液混合后,溶液的pH=1 NaOH溶液混合后,溶液的pH=1 |
D.0.1 mol·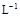 氨水中滴入0.1 mol· 氨水中滴入0.1 mol·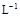 盐酸至溶液呈中性时,混合溶液中:c(N 盐酸至溶液呈中性时,混合溶液中:c(N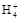 )=c(Cl-) )=c(Cl-) |