1 mL密度为0.93 g·cm―3的氨水恰好中和0.005mol H2SO4生成(NH4)2SO4,若要配制上述浓度的氨水,在1L水中需要溶解标准状况下的氨气( )
| A.294.7 L | B.378.0 L | C.2240.0 L | D.1120.0 L |
在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,m1与m2的关系是()
| A.m1一定大于m2 | B.m1可能等于m2 |
| C.m1一定等于m2 | D.m1可能大于m2 |
下列实验设计及其对应的离子方程式均正确的是()
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O = 2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O = 2H++Cl-+ClO- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO+6H++5H2O2= 2Mn2++5O2↑+8H2O |
NA代表阿伏加德罗常数,下列有关叙述正确的是()
| A.标准状况下,2.24 L CH2Cl2中含有 C—H 键数为 0.2 NA |
| B.常温下,100 mL 1 mol•L-1 Na2CO3溶液中阴离子总数大于 0.1 NA |
| C.分子数为NA的 CO、C2H4混合气体体积约为 22.4 L,其质量为 28 g |
| D.3.4 g NH3中含 N—H 键数目为 0.2 NA |
如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是()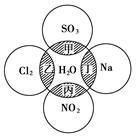
| A.甲、乙 | B.甲、丙 | C.乙、丙 | D.丙、丁 |
下列离子方程式与所述事实相符且正确的是()
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O = HClO+HCO3- |
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O = Al(OH)3↓+HCO3- |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3 = 2FeO42-+3Cl-+H2O+4H+ |