正常人血液中葡萄糖(简称血糖)为3.61~ 6.11(单位:mmol·.L―1),测得某人血液中血糖的质量分数0.1%,已知葡萄糖的相对分子质量为180设血液密度为1g·cm―3,通过计算判定某人血糖指标是多少?某人血糖是否正常?
现有A、B、C、D、E五种强电解质,分别含有下列阴阳离子(离子不可重复)。
| 阴离子 |
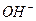 、 、 、 、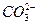 、 、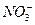 、 、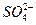 |
| 阳离子 |
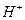 、 、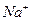 、 、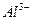 、 、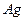 、 、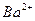 |
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②A、E两溶液反应既有气体,又有沉淀生成,A、C两溶液反应只有气体产生。
③D与其他四种溶液反应,均产生沉淀,C只与D反应产生沉淀。
试回答下列问题:
(1)写出:①B的化学式,②D与A反应生成难溶物的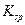 表达式。
表达式。
(2)A与E在溶液中反应的离子方程式为。
(3)将pH相同的等体积A、B两种溶液稀释相同倍数后,溶液的pH关系是: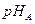
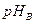 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)将C溶液逐滴加入到等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为 。
。
(5)在100mL 0.1 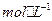 E溶液中,逐渐中入35 mL 2
E溶液中,逐渐中入35 mL 2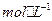
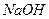 溶液
溶液 ,最终得到沉淀的物质的量为mol。
,最终得到沉淀的物质的量为mol。
某无色溶液X,K+、Ba2+、Al3+、Fe3+、[Al(OH)4]-、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验: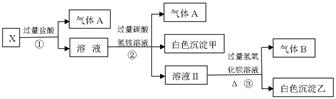
(1)气体A的成分是(填化学式,下同),气体B的成分是。
(2)写出步骤①中产生气体的离子方程式。
(3)分别写出形成白色沉淀甲和气体B的离子方程式
;。
(4)通过上述实验,可确定X溶液中一定存在的离子是,
尚未确定是否存在的离子是,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是。
按要求写出有水参与的氧化还原反应的化学方程式
(1)水是氧化剂:
(2)水是还原剂:
(3)水既不是氧化剂也不是还原剂:
(4)水既是氧化剂也是还原剂:
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内,配平后标出电子转移的方向和数目。
(2)反应中,被还原的元素是,还原剂是。
(3)纺织工业中常用氯气作漂白剂 ,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为。
,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为。
标准状况下,向100mLNaOH溶液中慢慢通入CO2气体充分反应后,在所得溶液M中逐滴加入1mol/L盐酸,(反应前后溶液体积变化忽略不计)所得气体体积和所加盐酸的体积关系如图。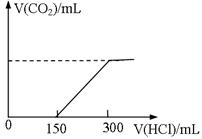
(1)c(NaOH)=
(2)取M溶液40mL与等体积的1mol/L盐酸按各种可能方式混合,产生气体的体积为VmL,则V的取值范围为。