硫酸的性质有:
| A.强酸性; | B.吸水性; | C.脱水性; | D.强氧化性。 |
在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
(1)实验室干燥氢气___________________;
(2)浓硫酸与金属铜的反应________________;
(3)实际生产中,浓硫酸可用钢瓶贮运_________;
(4)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。
Ⅰ.已知:R-CH=CH-O-R′ 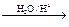 R-CH2CHO + R′OH
R-CH2CHO + R′OH
(烃基烯基醚)
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下: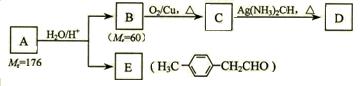
请回答下列问题:
⑴ A的分子式为_________________。
⑵ B的名称是__________;A的结构简式为_______________。
⑶写出C → D反应的化学方程式:_____________________________。
⑷写出两种同时符合下列条件的E的同分异构体的结构简式:
①属于芳香醛;②苯环上有两种不同环境的氢原子。
_________________________、________________________。
Ⅱ.由E转化为对甲基苯乙炔(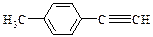 )的一条路线如下:
)的一条路线如下: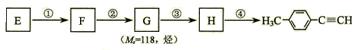
⑸写出G的结构简式:___________________________。
⑹写出①-④步反应所加试剂、反应条件和①-③步反应类型:
| 序号 |
所加试剂及反应条件 |
反应类型 |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
—— |
芳香化合物A、B互为同分异构体,B的结构简式是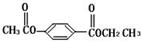
A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系 如图所示。
如图所示。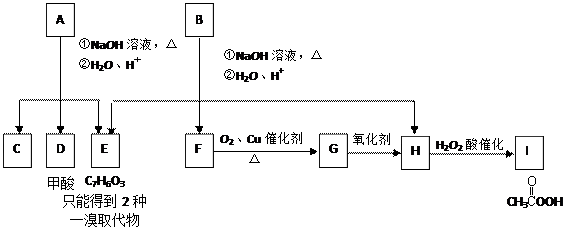
(提示:CH3COO-
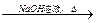 CH3COONa+
CH3COONa+ -ONa)
-ONa)
⑴写出E的结构简式 。
。
⑵A有2种可能的结构,写出相应的结构简式:
、。
⑶F和小粒金属钠反应的化学方程式是:。
⑷写出F在浓H2SO4作用下在170℃发生反应的化学方程式:
。
⑸写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式:
,
实验现象为:,反应类型:反应。
⑹在B、C、D、F、G、I化合物中,互为同系物的是。
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
B |
||||||
| D |
E |
F |
|||||
| C |
I |
G |
H |
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素的原子结构示意图
(2) 稳定性比较:D的氢化物G的氢化物(填“大于”“等于”或“小于)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为_____
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式________________
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:_______________________飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
(6)举一例说明C和I金属性的强弱
(7)用电子式表示由I和H组成的化合物的形成过程
等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为______,B的平均反应速率为______,x的值是______。
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为______,B的平均反应速率为______,x的值是______。
(1)今有氢氧燃料电池,则正极通入的气体是________,负极通入的气体是________,电解质溶液为稀硫酸时,电极反应式为:正极______________负极________________,电池的总反应式为
(2)如把H2改为甲烷、KOH作导电物质,则电极反应式为:负极________________