由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g) CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表: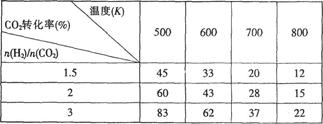
根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。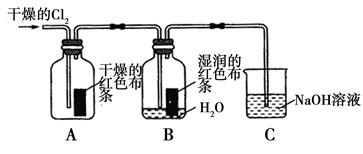
①通入Cl2后,观察到的现象是根据现象可得出的结论是______。
②集气瓶B发生反应的离子方程式是______。
③C装置的作用是______,若有2.24 L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子数为________mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。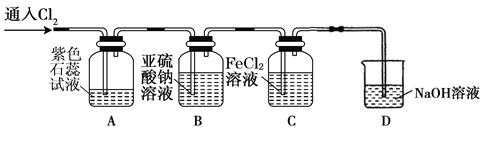
①实验开始后,观察装置A中的现象是:。
②装置C中发生反应的离子方程式是。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生反应的离子方程式是。
(14分)研究钠及其化合物有重要意义。
(1)NaOH是实验室中最常用的试剂之一。实验室进行某实验需要0.5 mol·L-1的氢氧化钠溶液约480 mL,根据溶液配制的过程,回答下列问题:
①实验除了需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是。
②根据计算得知,需用托盘天平(带砝码)准确称量NaOH固体 g。
(2)Na2O2可作为呼吸面具和潜水艇里氧气的。Na2O2作为供氧剂时可能发生的反应有、。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应: 2NaNO2+4HI===2NO↑+I2+2NaI+2H2O
①上述反应中,氧化剂是________。每生成标准状况下的NO气体2.24L,反应中被氧化的HI 的物质的量是mol。
②某厂废切削液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________。
| A.NaCl | B.NH4Cl | C.HNO3 | D.浓硫酸 |
(12分)某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+中的一种或几种离子。
①向此溶液中滴加足量稀盐酸无明显现象。
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生。
(1)原溶液中一定含有的离子是________,一定不含有的离子是________,不能确定是否含有的离子是________。
(2)②中反应的离子方程式为。
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
①OA段反应的离子方程式为。
②AB段反应的离子方程式为。
我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲肼”和四氧化二氮作为液体燃料。
(1)已知偏二甲肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮。则偏二甲肼的分子式为______;30g偏二甲肼中所含的氢原子数与标准状况下L CH4中所含的氢原子数相等。
(2)N2O4的摩尔质量是,等质量的N2O4和NO2中所含的原子数之比为。
(3)在发动机中物质的量之比为1∶2偏二甲肼和四氧化二氮恰好完全反应,生成CO2、H2O、N2,写出该反应的化学方程式__________________________________________。
甲醇(CH3OH)是一种可再生能,具有开发和应用的广阔前景,工业上一般可采用如下反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)t℃时,往1L密闭容器中充入1mol CO和2molH2。10min后,反应达到平衡,并测得CH3OH(g)的浓度为0.8 mol·L-1。
①该时间内反应速率v(H2) =____。t℃时,该反应的化学平衡常数K=(mol·L-1)-2
②下列各项中,能说明该反应已达到平衡的是_____________(填序号)
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,测得v正(CO) =v逆(CH3OH)
c.恒温、恒容条件下,容器内的气体密度不发生变化
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g)
(2)下图是该反应在T1 、T2温度下CO的转化率随时间变化的曲线。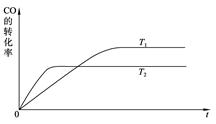
①该反应的焓变ΔH____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③若保持容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH =-b kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(g)ΔH=____________kJ·mol-1。
(4)我国在甲醇燃料电池技术方面已获得重大突破。甲醇燃料电池的工作原理如图所示。
①该电池工作时,b口通入的物质为______。
②该电池正极的电极反应式为。