在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)==3C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
⑴可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A、体系压强不再变化 B、v正(A)=2v逆(B)
C、体系的密度不再变化 D、混合气体的平均相对分子质量不再变化
⑵如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:
C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是
A、4molA+2molB B、6molC+1molD
C、1molA+0.5molB+1.5molC+0.5molD D、2molA+1molB+3molC+1molD
E、2molA+1molB+3molC+2molD
⑶若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol,则D的起始物质的量n(D)应满足的条件是 (用含W的代数式表示)
⑷此反应的v—t图象如甲图,若其他条件都不变,只是在反应前加入合适的催化剂,则
其v—t图象如乙图,请用“=、<、>”填空:①a1 a2;②b1 b2;③两图中
阴影部分面积:甲 乙。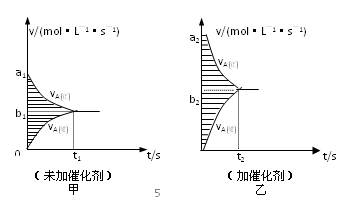
写出1---18号元素中符合下列条件的原子(离子)结构示意图:
①原子核外M电子层上有2个电子的原子;
②得到2个电子后,其电子层结构与Ne相同的离子;
③微粒带有一个单位的正电荷,核电荷数为11;
④微粒核外有18个电子,当失去1个电子时呈电中性;
⑤微粒不带电,其质数量为1
依次写出各微粒的结构示意图:、
、、
要分离下列五组混合物,分别用什么方法:
①饱和食盐水与沙子 ②水和汽油的混合物
③CCl4与甲苯的混合物(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.8℃ )
④ 食盐和水⑤氯化钠和硝酸钾
(1)在标准状况下________gCO体积为33.6 L;________个NH3分子的体积为44.8L。
(2)11.5g Na+中,含质子______个,电子的物质的量为
(3)写出下列物质的电离方程式:
Ba(OH)2
K2CO3
1814年戴维发现了一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。
(1)氯元素在元素周期表中的位置是____________________;ICl的电子式为____________。
(2)ICl与冷的NaOH稀溶液反应的离子方程式为________________________________。
(3)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,发生反应的化学方程式为_____。
(4)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的相对质量分别为198和269,其电离方程式为_________________________。
某校化学兴趣小组为研究Cl2单质的性质,设计如下图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是。
(2)加入药品前,检查I中气体发生装置气密性的操作是:____________________。
(3)装置Ⅱ的作用是。
(4)实验过程中,装置IV中的实验现象为___________________________________;发生反应的化学方程式为。
(5)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在_________之间还需添加洗气瓶(选填装置序号),该装置的作用是______________________。
(6)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式。