在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB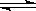 zC
zC
(1)若A、B、C都是气体,增大压强,平衡向正反应方向移动,则x+y与z关系是_____ __;
(2)若B、C是气体,A是固体,增大A的浓度,平衡 (填“正向移动”、“逆向移动”或“不移动”);
(3)若升高温度后,C的百分含量减小,则正反应是 (填“吸热”或“放热”)反应。
(4)若该可逆反应达到平衡时加入催化剂,平衡 (填“正向移动”、“逆向移动”或“不移动”);
(1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是。
(2)为防止氯气尾气污染空气,通常用溶液吸收多余的氯气;石灰乳吸收工业氯气尾气可制得漂白粉,漂白粉溶于水漂白织物时发生反应的离子方程式为。
(3)氯气一旦泄漏,后果是非常严重的。当人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是。
| A.NaOH | B.NaCl | C.KBr | D.Na2CO3 |
a、b、c、d、e是含有一种相同元素的五种物质,可发生如图所示的转化。其中: a是单质;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是淡黄色固体、b是臭鸡蛋气味的气体。则a的化学式为,b、e的名称分别为、c变d的化学方程式为。
(2)如果a是空气中含量最大的气体、b为气态氢化物,d是红棕色气体。则c的化学式为;a生成b的化学方程式为;d生成e的离子方程式为。
现有四种短周期元素X、Y、Z、W,它们的原子序数依次增大。其中:①X原子是元素周期表中原子半径最小的;②Y的L层电子是K层电子的2倍;③Z的最外层电子是内层电子的3倍;④W与X同主族。请回答下列问题:
(1)X的元素符号为,Y在周期表中的位置是 ,
Z单质的化学式为。
(2)X与Z组成的含有非极性共价键的化合物的分子式为 ;化合物W2Z2的电子式为 。
(3)向Na2SiO3的溶液中缓慢通入过量的YZ2,反应的离子方程式是 ;分子中有10个电子,则X与Z组成的分子为、X与Y组成的分子式为_______。
(1)写出下列反应的化学方程式:
①铝热反应(铝粉与四氧化三铁):;
②铜片与过量的浓硫酸共热:;
(2)写出下列反应的离子方程式:
③铵盐溶液与烧碱溶液共热:;
④铜片与浓硝酸反应:。
降低大气中CO2的含量、减缓温室效十分重要。
(1)工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 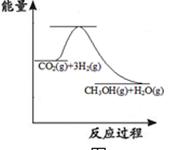
上图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是(填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示。则加入催化剂的曲线是(填:a或b);
0—8min内该反应的平均速率v(CO2)=mol/(L·min)。
(3)在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为a kJ,破坏1molO=O键消耗的能量为bkJ,形成1molC=O键释放的能量为ckJ。则1molCO在空气中完全燃烧生成CO2放出的能量为
kJ。